结直肠癌发病率位居全球恶性肿瘤第4位,死亡率位居第2位[1]。2015年统计数据显示,我国结直肠癌每年新发病例37.6万,死亡病例19.1万[2]。近年来随着结直肠癌筛查的普及、检查和治疗水平的提高,结直肠癌的早期诊断率、局部控制率和生存率均有明显提高。尿酸(UA)是人体内核酸嘌呤的代谢终末产物,在人体内主要以尿酸盐的形式存在于细胞内及细胞液中,其含量与嘌呤食物的摄入及体内核酸的分解代谢有关,且受生活方式、年龄等因素的影响。UA生成与排泄的平衡维系着机体内血UA水平稳态,平衡失调则会导致高尿酸血症[3-4]。流行病学数据显示,近20年来我国高尿酸血症的患病率至少增加了10倍,约有1.2亿病人,且有年轻化趋势[5]。现有研究结果表明,血清UA水平的升高与肾脏损伤、心血管系统疾病、肺癌及肠道屏障的损伤等密切相关[6-8]。多项研究表明,血清UA水平的升高是恶性肿瘤发生及预后不良的独立危险因素[9-11]。且UA的促炎特性在癌症的发生发展中可能起重要作用[3]。本研究探讨血清UA水平评估结肠癌病人淋巴结转移的价值,以期通过控制血清UA水平改善结肠癌病人预后。
1 资料与方法 1.1 一般资料2014年1月—2019年1月,我院胃肠外科收治、经手术治疗并术后病理确诊结肠癌病人857例,收集其临床及病理资料,包括年龄、性别、体质量指数、肿瘤最大直径、肿瘤位置、有无淋巴结转移以及手术前血清UA、总蛋白(TP)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、肌酐(Cr)、尿素氮(UN)、癌胚抗原(CEA)等检查结果。所有资料通过电子病历系统收集。按2010年WHO消化系统肿瘤组织学分类标准进行结肠癌诊断及分级,所有病人均为初次诊断结肠癌,未经过任何治疗,并且排除原发性痛风、高尿酸血症、心血管疾病、高血压、糖尿病、传染病、肝肾功能不全及其他恶性肿瘤病人。
1.2 统计学分析应用SPSS 23.0软件进行统计学分析。首先应用Kolmogorov-Smirnov法对连续变量进行正态性检验,正态分布的计量资料结果以±s形式表示,数据间比较采用t检验;非正态分布计量资料结果以M(P25,P75)形式表示,数据间比较采用秩和检验。将单因素相关分析结果中结肠癌有无淋巴结转移组间差异有统计学意义的变量纳入二元Logistic回归分析,应用二元Logistic回归分析法分析与结肠癌淋巴结转移相关的可能因素。应用受试者工作特征曲线(ROC曲线)分析血UA作为结肠癌转移评估指标的灵敏度和特异度。P < 0.05表示差异有统计学意义。
2 结果 2.1 结肠癌有无淋巴结转移组临床特征比较本文857例病人中伴淋巴结转移组(B组)192例,无淋巴结转移组(A组)665例,伴淋巴结转移组血清UA、CEA及血Cr水平明显高于无淋巴结转移组(Z=-5.291~-2.430,P < 0.05),肿瘤直径≥5 cm病人构成比较无淋巴结转移组小,差异有统计学意义(χ2=4.080,P < 0.05)。见表 1。
| 表 1 有无淋巴结转移结肠癌病人临床特征比较 |
|
|
将上述单因素分析有统计学差异的变量纳入二元Logistic回归分析中,以肿瘤直径、血UA水平、血Cr水平及CEA水平为连续性变量,因变量设定为结肠癌是否发生了淋巴结转移,是=1,否=0;连续性变量以原始数值形式纳入分析中,以OR值>1.000为危险因素,OR值≤1.000为保护因素。分析结果显示,肿瘤直径与结肠癌病人淋巴结转移的发生呈负相关(OR=0.922,P=0.035), 在其他因素不变的情况下,肿瘤直径每增加1 cm,结肠癌发生淋巴结转移的风险就降低7.8%。而血清UA、CEA水平则与结肠癌病人淋巴结转移的发生呈正相关(OR=1.007、1.004, P < 0.05),在其他因素不变的情况下,血清UA水平每增加1 μmol/L,结肠癌病人发生淋巴结转移的可能性将增加1.007倍;血清CEA水平每增加1 μg/L,结肠癌病人发生淋巴结转移的可能性增加1.004倍。各相关因素的相对危险度及其95%CI见表 2。
| 表 2 与结肠癌病人淋巴结转移相关因素的二元Logistic回归分析 |
|
|
分别以血清UA水平、CEA水平和肿瘤直径为指标绘制ROC曲线。以血清UA水平评估结肠癌淋巴结转移的ROC曲线下面积为0.764,其截断值为222.55 μmol/L时诊断灵敏度为72.4%,特异度为65.6%。血清CEA水平评估结肠癌淋巴结转移的ROC曲线下面积为0.579,截断值为5.23 μg/L时诊断的灵敏度为44.3%,特异度为70.8%。肿瘤直径评估结肠癌淋巴结转移的ROC曲线下面积为0.440,截断值为2.75 cm时诊断灵敏度为96.4%,特异度为8.5%。见图 1。
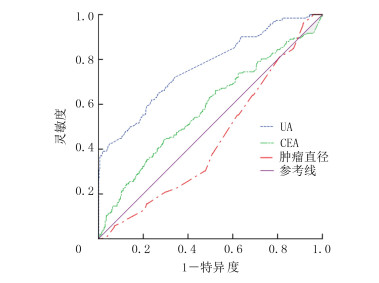 |
| 图 1 图结肠癌淋巴结转移相关性的ROC曲线 |
多项研究结果显示,血清UA水平与直肠癌等恶性肿瘤存在相关性,血清UA水平增加是癌症发病率和死亡率升高的独立危险因素[12-15]。CHENG等[16]研究显示,高尿酸血症是直肠癌淋巴结转移的独立危险因素之一,而血清UA水平是食管鳞癌、鼻咽癌、口腔鳞癌等肿瘤预后不良的独立预测因素[17-18]。本文研究检测了结肠癌病人未经治疗时的血清UA水平,结果显示,与无淋巴结转移的结肠癌病人相比,伴淋巴结转移的病人血清中UA、CEA及Cr水平明显升高,肿瘤直径≥5 cm者构成比较小。Logistic回归分析结果显示,血清UA、CEA水平及肿瘤直径与结肠癌转移存在相关性。血清UA水平与结肠癌病人淋巴结转移的发生呈正相关,是一项重要的结肠癌病人淋巴结转移的预测指标。
澳大利亚一项包含了21 683例女性受试者、平均随访时间达15年的前瞻性研究表明,血清UA水平升高是乳癌、女性生殖系统肿瘤等多种恶性肿瘤预后不良的指标之一[9]。还有研究表明,癌症病人病变组织增殖及核酸复制加快,而核酸分解会导致内源性途径嘌呤产生增多,进而导致血清UA水平升高,这可能是恶性肿瘤转移与UA值升高存在相关性的主要原因[19]。UA通过炎症反应参与代谢途径,高水平的血清UA可能导致代谢综合征[20],而代谢综合征引起的全身炎症反应、胰岛素抵抗和氧化应激可能增加结直肠肿瘤的远处转移率及死亡率[21-22]。部分非肿瘤性疾病中血清UA水平被认为与炎症及氧化应激有关[23],UA通过单钠尿酸盐(MSU)结晶或可溶性因子两种方式发挥促炎作用。①MSU结晶可被Toll样受体4识别,从而促进白细胞产生促炎细胞因子[24];②细胞内UA水平升高,激活MAP激酶(p38和ERK),进而激活NF-κB炎性通路,诱导MCP-1和C反应蛋白等炎症递质的表达[25]。还有研究表明,细胞内高浓度的UA可引起肿瘤细胞炎症和氧化应激反应,引起血管内皮损伤,从而促进肿瘤细胞转化、增殖、浸润和血管生成,有利于肿瘤的侵袭和转移[26-28]。
MORI等[29]研究发现,血清CEA和C反应蛋白水平是判断结直肠癌病人预后的生物学指标。血清CEA是目前临床最常应用于监测结直肠癌病人预后的指标之一[30]。但血清UA水平与结肠癌病人肿瘤转移的关系尚不清楚。本文研究结果显示,结肠癌病人血清UA水平与结肠癌淋巴结转移的发生呈正相关,血清UA水平升高可能预示结肠癌转移。提示血清UA可能是一种新的评估结肠癌转移的肿瘤标志物。但本研究中样本量相对较小,研究结果存在一定的局限性,且为单中心回顾性研究,与血清UA水平相关的因素如饮食、饮酒、生活习惯等因素也没有被纳入分析,还需要更多大样本高质量的临床研究来进一步明确血清UA水平与肿瘤转移之间的关系。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68(6): 394-424. |
| [2] |
CHEN W Q, ZHENG R S, BAADE P D, et al. Cancer statistics in China, 2015[J]. CA-A Cancer Journal for Clinicians, 2016, 66(2): 115-132. |
| [3] |
吴冕, 陈海冰. 高尿酸血症与癌症[J]. 中华内分泌代谢杂志. |
| [4] |
高尿酸血症相关疾病诊疗多学科共识专家组. 中国高尿酸血症相关疾病诊疗多学科专家共识[J]. 中华内科杂志, 2017, 56(3): 235-248. |
| [5] |
李静, 李雨璘, 黄艳. 高尿酸血症的流行病学研究[J]. 中国心血管杂志, 2010, 15(6): 415-417. |
| [6] |
KIM S Y, GUEVARA J P, KIM K M, et al. Hyperuricemia and coronary heart disease: asystematic review and Meta-analysis[J]. Arthritis Care & Research, 2010, 62(2): 170-180. |
| [7] |
孙焕珍, 左翔, 袁慧. 高尿酸血症与代谢综合征关联性的流行病学研究进展[J]. 安徽医药, 2017, 21(4): 587-591. |
| [8] |
李雨璘, 王凌, 李静, 等. 尿酸与肾脏疾病发生和预后关系的系统评价和荟萃分析[J]. 中华内科杂志, 2011, 50(7): 555-561. |
| [9] |
STRASAK A M, RAPP K, HILBE W, et al. The role of se-rum uric acid as an antioxidant protecting against cancer: prospective study in more than 28 000 older Austrian women[J]. Annals of Oncology, 2007, 18(11): 1893-1897. |
| [10] |
SIDDIQUI A A, PALMER B F. Metabolic syndrome and its association with colorectal cancer: a review[J]. The American Journal of the Medical Sciences, 2011, 341(3): 227-231. |
| [11] |
KIM H J, KIM J E, JUNG J H, et al. Uric acid is a risk indicator for metabolic syndrome-related colorectal adenoma: results in a korean population receiving screening colonoscopy[J]. The Korean Journal of Gastroenterology, 2015, 66(4): 202-208. |
| [12] |
HORSFALL L J, NAZARETH I, PETERSEN I. Serum uric acid and the risk of respiratory disease:a population-based cohort study[J]. Thorax, 2014, 69(11): 1021-1026. |
| [13] |
李远强, 陈爱军, 周欣, 等. 血清尿酸与转移性和非转移性直肠癌患者的关系[J]. 河北医药, 2017, 39(7): 1005-1007. |
| [14] |
TANRIVERDI O, COKMERT S, OKTAY E, et al. Prognostic significance of the baseline serum uric acid level in non-small cell lung cancer patients treated with first-line chemotherapy: a study of the Turkish Descriptive Oncological Researches Group[J]. Medical Oncology, 2014, 31(10): 3-7. |
| [15] |
DOVELL F, BOFFETTA P. Serum uric acid and cancer mortality and incidence: a systematic review and meta-analysis[J]. European Journal of Cancer Prevention, 2018, 27(4): 399-405. |
| [16] |
YUAN Cheng, XU Xinhua, WANG Xiaolong, et al. Relationship between serum uric acid and metastatic and nonmetastatic rectal cancer patients with undergoing no chemotherapy[J]. Medicine, 2016, 95(47): e5463. |
| [17] |
DU Xiaojing, CHEN Lei, LI Wenfei, et al. Use of pretreatment serum uric acid level to predict metastasis in locally advanced nasopharyngeal carcinoma[J]. Head & Neck, 2017, 39(3): 492-497. |
| [18] |
YAN Shushan, ZHANG Pengju, XU Wei, et al. Serum Uric acid increases risk of cancer incidence and mortality: a syste-matic review and Meta-analysis[J]. Mediators of Inflammation, 2015, 2015: 1-7. |
| [19] |
SEVANIAN A, DAVIES K J, HOCHSTEIN P. Serum urate as an antioxidant for ascorbic acid[J]. The American Journal of Clinical Nutrition, 1991, 54(6): 1129S-1134S. |
| [20] |
YANG T, CHU C H, BAI C H, et al. Uric acid level as a risk marker for metabolic syndrome: a Chinese cohort study[J]. Atherosclerosis, 2012, 220(2): 525-531. |
| [21] |
LIN C Y, CHIH H L, CHIEN C H, et al. Impact of high glucose on metastasis of colon cancer cells[J]. World Journal of Gastroenterology: WJG, 2015, 21(7): 2047-2057. |
| [22] |
MILLS K T, BELLOWS C F, HOFFMAN A E, et al. Diabetes mellitus and colorectal cancer prognosis: a Meta-analysis[J]. Diseases of the Colon & Rectum, 2013, 56(11): 1304-1319. |
| [23] |
LIU Jing, XU Chengfu, YING Limei, et al. Relationship of serum uric acid level with non-alcoholic fatty liver disease and its inflammation progression in non-obese adults[J]. Hepatology Research: the Official Journal of the Japan Society of Hepatology, 2017, 47(3): E104-E112. |
| [24] |
MARTINON F. Update on biology: uric acid and the activation of immune and inflammatory cells[J]. Current Rheumatology Reports, 2010, 12(2): 135-141. |
| [25] |
SAUTIN Y Y, NAKAGAWA T, ZHARIKOV S, et al. Adverse effects of the classic antioxidant uric acid in adipocytes: NADPH oxidase-mediated oxidative/nitrosative stress[J]. American Journal of Physiology-Cell Physiology, 2007, 293(2): C584-C596. |
| [26] |
蒋传林, 田山, 董卫国. 高尿酸血症与胃癌预后关系的研究[J]. 实用癌症杂志, 2019, 34(2): 207-210. |
| [27] |
RHONE E T, CARMODY J B. Birthweight and serum uric acid in American adolescents[J]. Pediatrics International, 2017, 59(8): 948-950. |
| [28] |
CHHANA A, LEE G, DALBETH N. Factors influencing the crystallization of monosodium urate: a systematic literature review[J]. BMC Musculoskeletal Disorders, 2015, 16(2/11): 296. |
| [29] |
MORI K, TOIYAMA Y, SAIGUSA S, et al. Systemic analysis of predictive biomarkers for recurrence in colorectal cancer patients treated with curative surgery[J]. Digestive Diseases and Sciences, 2015, 60(8): 2477-2487. |
| [30] |
HOTTA T, TAKIFUJI K, YOKOYAMA S, et al. Impact of the post/preoperative serum CEA ratio on the survival of patients with rectal cancer[J]. Surgery Today, 2014, 44(11): 2106-2115. |
 2020, Vol. 56
2020, Vol. 56

