视网膜色素变性(RP)是以早期夜盲, 随后出现渐进性视野缺损、视网膜色素沉着、视盘蜡黄色、视网膜电图呈熄灭型以及中心视力下降等为主要临床特征的常见致盲性遗传眼病[1]。在世界范围内RP的发病率为1/3 800~1/3 500, 在我国其发病率约为1/3 784, 全世界至少有100万病人[2]。此组疾病是导致人类视力障碍最主要的疾病之一。近年来, 由于其致盲率有所上升, 以及人类基因图谱的成功建立, RP日益受到眼科学者的关注。已知的RP致病基因或位点多达100个, 目前已经克隆50多个基因并阐述了其功能。至2015年, 已被定位克隆的常染色体显性遗传RP的致病基因有25个[3]。至今已知基因导致常染色体显性RP(ADRP)约占60%, 仍有40%的ADRP病人尚未确定致病基因[4-6]。因此, 对ADRP致病基因的定位和克隆仍需进行深入的研究[7]。本文研究对1个中国北方ADRP家系进行目标区域外显子测序, 以期找到该病的致病基因和突变位点, 并探讨该病的临床表型与基因型的关系, 旨在为ADRP的病人治疗带来福音。现将结果报告如下。
1 资料与方法 1.1 一般资料收集山东省临沂市1个ADRP家系, 该家系共有3代11人, 其中RP病人5例, 均经详细全面的眼科检查如视力、视野、眼底等明确诊断为ADRP。参与本研究的共有11例家系成员, 包括5例病人, 6例表型正常者。本研究严格遵守赫尔辛基宣言, 血液标本的采集和病人的临床检查均征得家系成员同意后进行。
1.2 方法 1.2.1 提取外周血基因组DNA采集所有家系成员的外周静脉血2~5 mL, 注入EDTA抗凝管内, 置于-80 ℃冰箱冻存备用; 采用全血DNA小量抽提试剂盒(天根生化科技有限公司, 北京)进行外周血DNA提取。
1.2.2 目标区域外显子组测序取该家系中先证者的基因组DNA, 应用目标序列捕获高通量测序技术捕获人类视觉系统异常相关单基因遗传病的523个基因的外显子区域, 然后对富集的外显子文库进行高通量测序。将突变的基因通过4个正常人的基因数据库进行过滤:包括单核苷酸多态性(SNP)数据库(ftp://ftp.ncbi.nih.gov/snp/database/)、千人基因组计划数据库(ftp://ftp-trace.ncbi.nih.gov/1000genomes/ftp/)、Hapmap8数据库(http://hapmap.ncbi.nlm.nih.gov/)及炎黄数据库(http://yh.genomics.org.cn/)。
1.2.3 PCR扩增和Sanger测序将经过分析筛选得到的获选变异位点分别利用PCR和Sanger测序验证。PCR反应条件:94 ℃、3 min; 94 ℃、40 s, 53 ℃、40 s, 72 ℃、60 s, 35个循环; 72 ℃ 10 min。然后, 应用Sanger测序法分别对每例家系成员的基因组DNA模板与核受体亚科2第E组第3个成员(NR2E3)引物的扩增PCR产物测序。
2 结果 2.1 临床特征该家系为ADRP, 共有11例家系成员(图 1), 其中包括5例RP病人(Ⅰ1, Ⅱ1, Ⅱ5, Ⅲ1, Ⅲ3)和6例健康成员(Ⅰ2, Ⅱ2, Ⅱ3, Ⅱ4, Ⅱ6, Ⅲ2)。眼科检查显示, 5例病人的临床表型均符合典型的RP的临床特征。该家系内5例病人的临床表现较为相似, 均自幼夜盲, 并在10岁左右出现明显的视野缩窄及视力下降。先证者Ⅱ1目前双眼最佳矫正视力均为0.1;其双眼眼底表现符合典型的RP改变, 包括视乳头色苍白、视网膜血管迂曲变细、视网膜萎缩及后极部大量骨细胞样色素沉着等。见表 1。
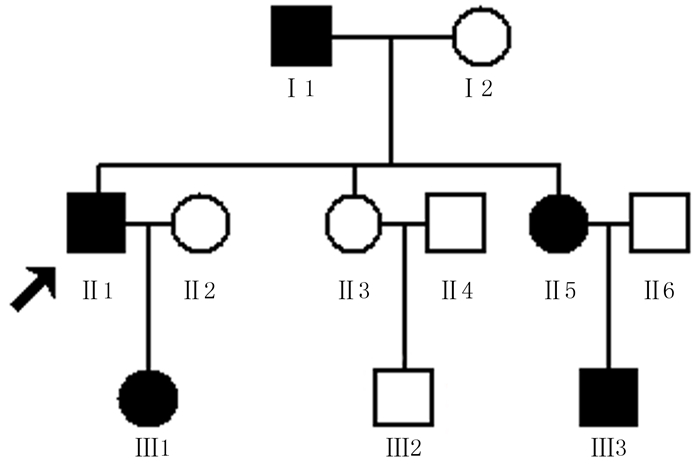 |
| ■男性病人, □健康男性, ●女性病人, ○健康女性, ↗先证者。 图 1 RP家系图 |
| 表 1 RP病人临床特征 |
|
|
针对家系内先证者(Ⅱ1)进行的目标区域捕获测序所达到的覆盖率为99.91%, 平均测序深度为61.4X。目标区域捕获测序共捕获到837个单核苷酸变异(SNVs)和82个插入/缺失变异(Indels)。经过4个SNP数据库对比过滤, 鉴于常染色体显性遗传的RP较少见, 只保留千人基因组计划数据库中等位基因频率小于0.05的突变, 共筛选出8个可能与该家系发病相关的变异, 这8个突变分别位于6个基因:NR2E3、BBS4、BBS9、PMM2、PDE6A、CIB2。见表 2。
| 表 2 RP候选基因 |
|
|
Sanger测序结果显示, 该家系中5例病人均存在NR2E3基因的第2外显子的突变, 核苷酸改变为c.166G>A, 氨基酸改变为p.56, G>R(图 2); 而家系中的6例正常人均不存在该突变。多次测序结果表明, 该突变位点并不是因为扩增或测序错误引进的。应用点突变预测程序SIFT和PolyPhen的预测结果均显示, 该突变导致了NR2E3蛋白功能“deleterious”级的损坏, 从而引起了病人RP的发生。该突变为已知突变, 不是新突变。
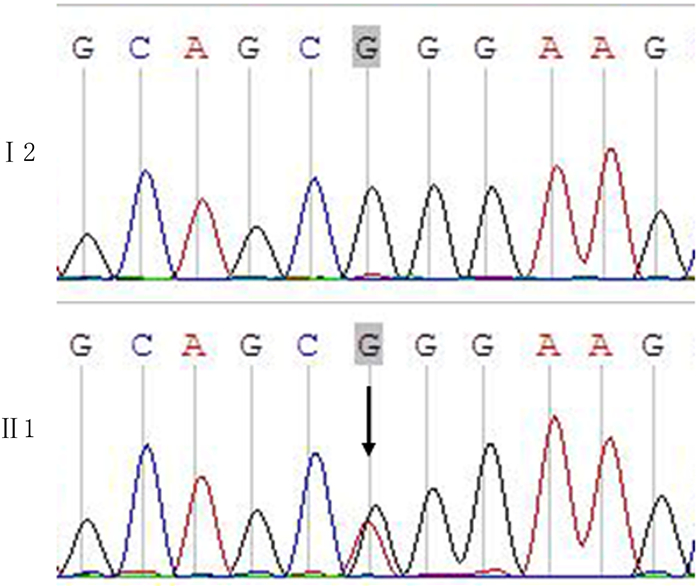 |
| Ⅰ2为正常人序列; Ⅱ1为先证者序列, 其NR2E3基因上发现杂合突变, 该突变位于第2外显子, 核苷酸改变c.166G>A(箭头所示)。 图 2 RP家系内成员NR2E3测序图 |
RP的遗传方式较为复杂, 目前已知有ADRP、常染色体隐性遗传RP(ARRP)、X-连锁遗传RP(XLRP)[8]、双基因型遗传RP(digenic RP)和线粒体遗传RP(mitochondrial RP)等5种。ADRP占RP的20%~25%, 目前共克隆出了25个致病基因, 由于ADRP危害较为严重, 发病率较高, 近年来已经成为眼科遗传学研究的热点[9]。视紫红质(RHO)是最早被发现导致RP突变的致病基因[10]。目前已经发现100多种致病突变, 90%以上的RHO突变是错义突变, 另外一些是缺失或移码突变[11]。在北美和欧洲人群中, RHO突变是导致ADRP最常见的原因, 占20%~25%。在日本, RHO突变率却较低, 仅为2.5%[12]。
NR2E3基因突变占ADRP致病突变的2%~6%, 定位15q23~q25, 含有8个外显子, 编码410种氨基酸的蛋白质[13]。该蛋白质也是配体依赖的转录因子, 只在成人视网膜外核层表达, 在神经细胞的信号转换、胚胎发育和功能调节方面发挥作用。NR2E3突变的病人的临床特征是后发性ARRP。最近有研究显示, NR2E3突变与ADRP有明显的关系[14]。NR2E3突变的ADRP病人除了具有典型的ADRP临床表现外, 还有眼底高荧光, 很少或几乎没有视网膜下色素沉着[15]。
NR2E3由5个主要结构域组成, 这些结构域在所有核激素受体中都是进化上保守的。N末端的结构域1和2含有高度可变的A/B结构域, 其有助于通过激活因子(AF-1)结构域的配体与非依赖性DNA结合; 结构域3是核受体最保守的区域, 含有DNA结合结构域(DBD)。DNA结合区还含有P-盒以及D-盒, P-盒允许核受体结合独特的DNA应答元件位点并调节基因表达, D-盒被认为参与蛋白质相互作用。结构域4包含可变铰链区并且通常是核受体中最独特的序列。结构域5位于C末端部分, 包括几个结构域:LBD、同源和异源二聚化结构域、核定位和配体依赖性激活因子(AF-2)结构域。配体结合结构域由12个α-螺旋组成, 其折叠可以产生配体结合的疏水口袋[16]。通过生物信息学分析发现, DBD位于第39~130位密码子之间, 本实验结果显示的突变发生在第56位密码子, 其位点在NR2E3上的位置处于功能结构域内[17]。
p.G56R突变位于NR2E3蛋白的DBD中, 而DBD有助于核受体的同聚和异聚。该位点突变会影响NR3E3同源二聚体的形成。在ADRP病人中, p.G56R突变体蛋白在CRX介导的光感受器特异性基因表达中起抑制作用, 这就是其导致RP发生的原因。本文研究中5例病人的临床表型均符合典型的RP临床特征, 主要包括视乳头色苍白、视网膜血管迂曲变细、视网膜萎缩及后极部大量骨细胞样色素沉着等。目标序列捕获高通量测序技术是一种新型的基因组分析技术, 该技术使用一套核苷酸探针捕获基因组上的目标序列, 然后使用通用引物对这些捕获到的序列进行扩增, 再对这些扩增产物进行高通量生物信息学分析[18]。本研究通过目标区域外显子组测序及Sanger测序技术并结合生物信息学分析和变异过滤策略, 成功地发现了RP致病基因NR2E3(c.166G>A, p.56, G>R)的突变位点。该突变导致了NR2E3基因所编码蛋白第56位氨基酸由甘氨酸突变为精氨酸(p.L51>P), 该突变在RP家系内共分离。
RP危害严重且目前尚无有效治愈方法, 发现RP可能的致病基因和有害突变, 并进行产前预防和基因治疗显得尤为重要[19]。目前已知基因导致的ADRP约占60%, 仍有40%的ADRP病人尚未确定其致病基因。因此, 对ADRP致病基因的定位和克隆仍需进行深入研究[20]。该病虽然是单基因遗传病, 但遗传异质性高, 有1/3~1/2的病例有遗传背景[21]。应用传统的诊断方法很难在分子水平做出正确的诊断。新一代测序技术能够准确地、全面地发现基因组中的各种DNA异常、遗传重组突变和其他各种突变等[22]。
自新一代测序技术问世以来, 我国在眼遗传性疾病致病基因的研究中取得前所未有的成果[23-24]。全外显子测序是指将基因组中外显子区域DNA捕获并富集后进行高通量测序的基因组分析方法。全部外显子区及外显子与内含子的交界区虽然只占全基因的1%, 但是大多数与遗传表型相关的功能性变异位于外显子区, 应用该技术已经找到了很多孟德尔遗传疾病的致病基因。致病基因的确定不仅有助于早期诊断和早期采取预防措施, 还可以诊断不同的致病基因从而采取不同的治疗措施, 如针对先天性黑矇致病基因RPE65的基因治疗可明显改善临床病人的病情[25-27]。已有研究在RP、先天性青光眼和先天性白内障等单基因遗传性疾病中发现新基因或已知基因新突变。还有研究应用全外显子测序技术发现了RP的致病基因SLC7M4[28]。另外, 在近视、原发性青光眼和年龄相关性黄斑变性等复杂性基因遗传性疾病中亦发现了新的相关性致病基因, 如与原发性开角型青光眼相关的基因ABCAI和PMM2[29]。当前遗传学及基因组学研究上的新突破, 使得我们能够从基因层面认识到遗传性疾病的成因, 从而使遗传性眼科疾病的基因诊断和治疗成为可能[30]。
综上所述, 本文对RP家系进行的基因检测显示, NR2E3(c.166G>A, p.56, G>R)基因上的突变位点可能导致了RP的发病。本研究结果不仅丰富了RP致病基因NR2E3的图谱, 而且将为常染色体显性遗传性RP的基因治疗、产前诊断和预防提供重要的参考。
| [1] |
高凤娟, 张圣海, 胡方圆, 等. 视网膜色素变性的致病基因研究进展[J]. 中华眼底病杂志, 2018, 34(6): 605-610. |
| [2] |
李润璞, 黄一飞, 刘铁城, 等. 原发性视网膜色素变性伴发症状的研究进展[J]. 解放军医学院学报, 2019, 40(5): 487-490. |
| [3] |
赵玉霞, 李克秋, 王建海, 等. 一个遗传性视网膜色素变性家系的基因变异分析[J]. 国际遗传学杂志, 2019, 42(1): 1-5. |
| [4] |
王晓光, 刘海军, 张少弛, 等. 视网膜色素变性和视锥-视杆细胞营养不良患者的基因型及临床表型分析[J]. 中华眼底病杂志, 2018, 34(6): 526-535. |
| [5] |
张轶, 黄熙, 张军军, 等. 光遗传学在视网膜色素变性治疗中的研究进展[J]. 中华眼底病杂志, 2018, 34(6): 601-604. |
| [6] |
张芷萌. 结晶样视网膜色素变性研究进展[J]. 中华实验眼科杂志, 2018, 36(7): 559-563. |
| [7] |
SÁNCHEZ M, VALERO P L, POZO M D, et al. And foveoschisis caused by a mutation in the MFRP gene: a familial study[J]. Ophthalmic Genetics, 2019, 40(3): 1-5. |
| [8] |
亢鸿飞, 白楠, 梅世月. 一个视网膜色素变性家系的基因诊断和产前诊断[J]. 中华医学遗传学杂志, 2018, 35(2): 184-187. |
| [9] |
杨琳, 蔡小军, 柯敏, 等. 视网膜色素变性黄斑区外层视网膜管状结构的OCT特征及临床意义[J]. 临床眼科杂志, 2019, 27(4): 304-306. |
| [10] |
白周现, 刘莉娜, 胡爽, 等. 一个导致视网膜色素变性的RHO基因新突变的鉴定[J]. 中华医学遗传学杂志, 2019, 36(3): 234-237. |
| [11] |
邹媛媛, 汪建涛, 李筱荣, 等. 玻璃体腔移植人脐带间充质干细胞对糖尿病大鼠视网膜形态及胶质细胞原纤维酸性蛋白和视紫红质表达的影响[J]. 中华眼底病杂志, 2016, 32(6): 596-600. |
| [12] |
SMIRNOV V M, MARKS C, DRUMARE I, et al. Severe retinitis pigmentosa with posterior staphyloma in a family with c.886C>A p.(Lys296Glu) RHO mutation[J]. Ophthalmic Genetics, 2019, 40(4): 365-368. |
| [13] |
GARAFALO A V, CALZETTI G, CIDECIYAN A V, et al. Cone vision changes in the enhanced S-Cone syndrome caused by NR2E3 gene mutations[J]. Investigative Ophthalmology & Visual Science, 2018, 59(8): 3209-3219. |
| [14] |
MAHAJAN D, VOTRUBA M. A novel NR2E3 gene mutation in autosomal recessive retinitis pigmentosa with cystic maculopathy[J]. Acta Ophthalmologica, 2018, 96(4): e535-e536. |
| [15] |
ESCHER P, VACLAVIK V, MUNIER F L, et al. Presence of a triple concentric autofluorescence ring in NR2E3-p.G56R-linked autosomal dominant retinitis pigmentosa (ADRP)[J]. Investigative Ophthalmology & Visual Science, 2016, 57(4): 2001-2002. |
| [16] |
白周现, 胡爽, 孔祥东, 等. NR2E3基因纯合新突变致Goldmann-Favre综合征一家系[J]. 中华眼底病杂志, 2018, 34(6): 541-545. |
| [17] |
KUNIYOSHI K, HAYASHI T, SAKURAMOTO H, et al. New truncation mutation of the NR2E3 gene in a Japanese patient with enhanced S-cone syndrome[J]. Japanese Journal of Ophthalmology, 2016, 60(6): 476-485. |
| [18] |
童永清, 李艳. 高通量测序平台发展及在临床分子诊断中的应用与展望[J]. 中华检验医学杂志, 2019, 42(2): 73-76. |
| [19] |
高青. 视网膜色素变性疾病的药物治疗基础研究进展[J]. 中华实验眼科杂志, 2018, 36(1): 70-74. |
| [20] |
张珂凡, 曲秀霞. 干细胞治疗视网膜退行性疾病[J]. 中华实验眼科杂志, 2018, 36(11): 871-877. |
| [21] |
刘家琪, 王英, 蒋鹏飞, 等. 枸杞丹参对视网膜色素变性大鼠视网膜组织形态学及CRYAB mRNA的影响[J]. 中国医药导报, 2019, 16(14): 14-15. |
| [22] |
饶书权, 杜廷福, 许琪. 外显子组测序在人类疾病中的应用[J]. 遗传, 2014, 36(11): 1077-1086. |
| [23] |
韦懿芸, 曾繁娟, 庞丽红, 等. 外显子测序联合Sanger测序行X-连锁重症联合免疫缺陷家系分析及产前诊断1例报告[J]. 广西医学, 2019, 41(14): 1770-1773. |
| [24] |
HU Yanshan, SONG Hui, LI Yin, et al. Whole-exome sequencing identifies novel mutations in genes responsible for retinitis pigmentosa in 2 nonconsanguineous Chinese families[J]. International Journal of Ophthalmology, 2019, 12(6): 915-923. |
| [25] |
李启英, 张君, 庞爽, 等. 外显子测序技术在人类疾病中的应用研究[J]. 中国优生与遗传杂志, 2019, 27(3): 381-384. |
| [26] |
LE MEUR G, LEBRANCHU P, BILLAUD F, et al. Safety and long-term efficacy of AAV4 gene therapy in patients with RPE65 leber congenital amaurosis[J]. Molecular Therapy: the Journal of the American Society of Gene Therapy, 2018, 26(1): 256-268. |
| [27] |
MIRALDI UTZ V, COUSSA R G, ANTAKI F, et al. Gene therapy for RPE65-related retinal disease[J]. Ophthalmic Genetics, 2018, 39(6): 671-677. |
| [28] |
NEVELING K, COLLIN R W, GILISSEN C, et al. Next-generation genetic testing for retinitis pigmentosa[J]. Human Mutation, 2012, 33(6): 963-972. |
| [29] |
吴若豪, 邱坤银, 李栋方, 等. 一例Ⅰa型先天性糖基化障碍病患儿的PMM2基因变异分析[J]. 中华医学遗传学杂志, 2019, 36(4): 314-317. |
| [30] |
范祥雨. CRISPR/Cas9基因组编辑技术在眼科疾病研究中的应用[J]. 中华实验眼科杂志, 2018, 36(7): 553-558. |
 2020, Vol. 56
2020, Vol. 56

