2. 青岛大学附属医院影像科
恶性骨肿瘤在青少年中的发病率较高, 选择合理截骨平面, 对提高病人的生存质量及预后尤为重要。传统CT分辨率较差, 不能清楚地显示肿瘤边界[1]。磁共振能较清楚地显示肿瘤大体浸润范围, 但对于肿瘤微观浸润显示尚未达成一致[2-5]。能谱CT可以通过两个不同电压的X线球管的几乎同时的扫描或单一球管两个峰值电压的瞬时切换, 实现40~140 keV的单能量图像重建, 单能量图像模式与传统CT相比能够提高图像质量[6]。同时, 能谱CT分析平台提供了反映不同物质特征的X线衰减曲线即能谱曲线, 可以客观反映病灶的细微病理变化[7]。目前, 能谱CT在肌骨系统的疾病诊断方面也展现出优势, 特别是在骨髓水肿的显示方面[8-10]。本研究通过建立兔VX2恶性骨肿瘤模型, 探讨能谱CT曲线鉴别恶性骨肿瘤内的肿瘤微观浸润及单纯骨髓水肿的价值。
1 材料与方法 1.1 兔VX2骨肿瘤模型的建立新西兰大白兔32只(青岛市药品监督管理所提供), 雌雄不限, 年龄2.0~2.5个月; 体质量2.0~3.0 kg, 平均(2.4±0.6)kg。将VX2瘤株接种于2只兔股骨周围肌群, 14 d后全身麻醉下剥离肿瘤并剔除坏死及纤维组织, 制备成1 mm3组织块备用。余30只新西兰大白兔应用氯胺酮1.6 mL/kg和地西泮1 mL/kg先后耳缘静脉注射麻醉, 纵行切开右侧胫骨近端较平坦处皮肤, 暴露胫骨近端骨皮质。用牙科钻钻孔, 将2块VX2肿瘤组织块送入骨髓腔, 骨蜡封口, 缝合, 制备兔VX2骨肿瘤模型。术后3 d肌注青霉素20万单位。所有动物饲养于青岛大学附属医院动物实验室(采用标准室温及专用兔粮)。
1.2 CT检查方法模型兔生长到4周时, 全身麻醉, 取仰卧位, 进行CT扫描(Discovery CT750HD, GE Healthcare, Milwaukee, Wisconsin, USA), 扫描范围包括患侧的膝关节及踝关节。筛选出23只肿瘤种植成功的模型兔纳入研究。CT检查包括常规120 kVp扫描和双能CT扫描。常规平扫:层厚0.625 mm, 管电压120 kVp, 管电流100 mA, 层间隔为0.625 mm, 螺距为0.531。能谱CT的扫描参数为:管电压为140和80 kVp瞬时切换, 管电流为600 mA, 层厚为0.625 mm, 螺距为0.531, 转速每周0.6 s。
1.3 图像处理与分析用Advanced Workstation(AW 4.4; GE Heal-thcare, Waukesha, Wisconsin, USA)工作站进行图像重建与数据测量。分析不同的单能量图像, 利用最佳对比噪声比(CNR)曲线得出最佳单能量为140 keV(图 1A)。并进行120 kVp的常规图像与140 keV的能谱图像多平面重建(MPR)。分别选取肿瘤实性成分及髓腔为感兴趣区(ROIs)和背景。
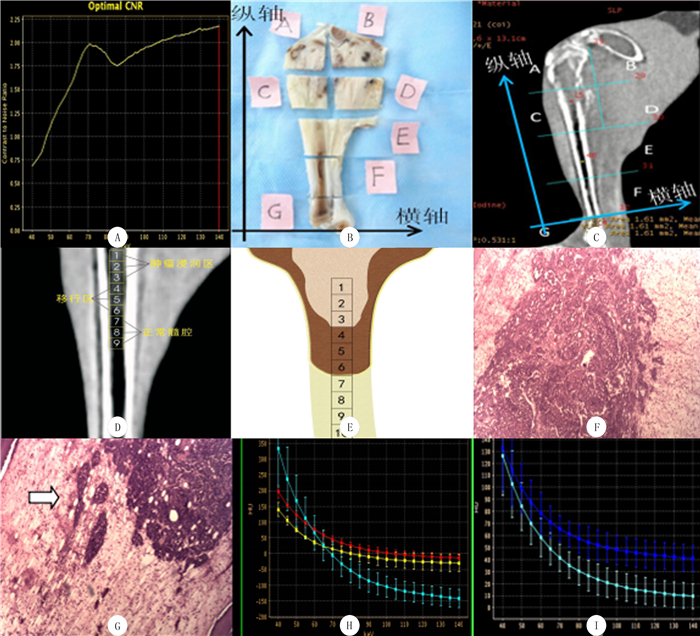 |
| A:CNR曲线; B:标本分区; C:与病理切片匹配的CT矢状位图像; D:140 keV最佳单能量图像(依据病理图片, 在肿瘤浸润区、移行区及正常髓腔区分别放置ROIs); E:为D的示意图; F:单纯骨髓水肿病理表现(肿瘤边缘清晰, 周围单纯骨髓水肿。HE染色, 40倍); G:肿瘤微观浸润病理表现(肿瘤细胞排列散在巢状(白色箭头示)为肿瘤微观浸润区, 周围骨髓明显水肿。HE染色, 40倍); H:肿瘤区、移行区及骨髓区能谱曲线斜率图(绿色:正常骨髓区, 红色:移行区, 黄色:肿瘤区); I:移行区能谱曲线斜率图(绿色:肿瘤微观浸润区, 蓝色:单纯骨髓水肿区)。 图 1 恶性骨肿瘤髓内浸润能谱CT与病理对照 |
影像学检查完毕, 立即耳缘静脉注射过量盐酸氯胺酮处死模型兔, -60 ℃冷冻。根据CT矢状位重建图像, 将标本切成厚度约为2 mm的组织片, 最佳切片不仅包含最大范围的肿瘤区域还要与CT图像相匹配。纵轴平行胫骨骨皮质前外侧缘, 横轴垂直于胫骨前缘骨皮质, 分区的大小以载玻片的大小及不破坏骨髓腔为原则, 对标本进行分区, 其面积约为2.0 cm×2.0 cm或2.0 cm×1.5 cm(图 1B、C)。随后对标本进行编号和拍照。而后置于40 g/L甲醛中固定, 40 g/L稀盐酸溶液中脱钙, 最后将组织块包埋、切片, 苏木精-伊红(HE)染色。
1.5 能谱曲线与病理对照研究由两名病理科医师确定肿瘤区、正常骨髓组织及移行区(位于两者之间)。移行区在病理上包括肿瘤骨髓微观浸润区和单纯水肿区。CT图像分析由两名放射科医师完成, 对肿瘤区、移行区及正常区域进行能谱曲线分析。对照病理结果, 将3~5个连续ROIs分别放在肿瘤区、移行区及正常区域, ROIs的大小为2.0 mm×2.0 mm或2.0 mm×1.5 mm (图 1D、E)。工作站自动生成能谱曲线, 以单能量值为横坐标, CT值为纵坐标。在40~70 keV间曲线较陡直, 以这两个点作为参考点来计算能谱曲线斜率。
1.6 统计学方法采用SPSS 17.0统计软件进行数据分析, 结果以x±s形式表示, 数据间比较采用单因素方差分析和t检验。以P<0.05为差异有统计学意义。
2 结果 2.1 CT图像与病理对照大体标本:VX2肿瘤在髓腔内浸润生长, 切面呈灰白色鱼肉状, 病变中心区可见明显坏死(20例)及出血(12例)。光镜下:骨髓正常结构消失, 由大量深染的细胞取代, 细胞形态大而圆, 排列密集呈瘤巢状, 其内细胞间质少, 并少见角化区; 肿瘤细胞高度异型且为未分化细胞, 胞浆稀疏, 核大且染色质丰富, 可见较多核分裂象; 凝固性坏死区的肿瘤细胞皱缩, 细胞核小, 表现为红染的无结构区。骨髓水肿镜下特点为:正常骨髓组织粉染, 边界不清(图 1F)。肿瘤髓腔内微观浸润表现为:肿瘤细胞排列成团状或巢状, 分散在髓腔内(图 1G)。微观浸润7例, 单纯骨髓水肿16例。肿瘤微观浸润范围为0.90~1.72 cm, 平均(1.27±0.42)cm。传统120 kVp混合能量CT不能显示肿瘤移行区。能谱CT图像中22例可见位置及CT值均介于肿瘤区域和正常骨髓腔间的移行区, 显示清楚的有7例, 其中既有病理结果显示的肿瘤微观浸润(4例), 也有单纯骨髓水肿(3例); 模糊15例; 1例未显示移行区, 病理切片结果为轻度骨髓水肿。
2.2 能谱曲线与病理对照移行区能谱CT的曲线斜率(7.79±3.40)大于肿瘤区(3.72±2.15), 而小于正常骨髓区(12.89±4.12), 差异有显著性(F=142.03, P<0.01)。移行区中肿瘤微观浸润区的能谱曲线斜率为(10.88±2.69), 大于水肿区斜率(5.84±2.11), 差异有显著性(t=-9.30, P<0.01)。见图 1H、I。
3 讨论能谱CT能够提供40~140 keV的101个不同的单能量图像。低能量水平图像能够提高图像的密度分辨率, 有助于病灶检出; 高能量图像虽然降低了图像对比度, 但是可以有效去除伪影[11]。研究显示, 140 keV具有最佳CNR, 能谱CT单能量图像能够降低线束硬化伪影并提高图像质量[12], 有利于移行区显示。本文研究的能谱图像可显示大多数肿瘤移行区(22/23), 1例病理显示轻度骨髓水肿, 在能谱CT图像中未能显示。能谱CT单能量图像在显示骨肿瘤边界方面有明显优势。
本文结果显示, 能量段40~70 keV水平斜率变化大, 这与X线能量越低, 吸收系数越大, X线衰减量有关[13]。因此, 本研究选择40~70 keV作为定量分析的指标。双能CT能谱曲线反映了随着能量增加, CT值发生的变化。不同组织类型有不同的能谱曲线[14]。本研究ROIs大小的选择, 主要是考虑兔胫骨骨髓腔较窄, 避免部分容积效应, 同时避免肿瘤的坏死、囊变、出血和钙化等[15]。由于兔龄较小, 正常髓腔内丰富的红骨髓含有更多的细胞内液及细胞间隙液[16], 曲线陡峭、斜率大; 肿瘤区含有大量的肿瘤细胞, 细胞形态大而圆, 排列密集呈瘤巢状, 其内细胞间质少, 并少见角化区, 曲线较平直、斜率小; 肿瘤移行区是由些许肿瘤细胞(微观浸润)或者水肿(其内可能混有一些炎性细胞及坏死组织)构成[10, 16], 在位置和成分上都是起过渡作用的, 因此移行区能谱曲线斜率应该介于肿瘤组织和正常骨髓组织之间。正常骨髓在微观浸润区域或者水肿区域周围, 并不混有肿瘤细胞或者水肿, 因此可以和移行区鉴别。通过能谱CT图像密度的差异可区分肿瘤区、移行区及正常髓腔, 能谱曲线斜率的不同进一步证实了三者间的差别。
肿瘤移行区是由肿瘤细胞(微观浸润)或者水肿组织构成(其内可能混有一些炎性细胞及坏死组织, 选取ROIs时已避开坏死区)。肿瘤微观浸润在病理学上表现为肿瘤细胞单个或成簇状分布, 红骨髓含量减少, 周围骨髓明显水肿。病理表现肿瘤微观浸润区骨髓水肿较单纯骨髓水肿明显, 使得肿瘤微观浸润区斜率高于单纯骨髓水肿。总之, 能谱曲线斜率能够鉴别密度值差别较小的不同组织成分。
本研究存在以下局限性:首先, 本研究的样本量小, 病种单一; 其次, 受实验设备限制, 不能在光镜下进行完整大体标本观察; 第三, 运用能谱曲线来区分肿瘤微观浸润区或者单纯水肿区, 表现并不直观, 今后的研究需把曲线直接转换成彩图, 更直观地显示不同的区域; 第四, 本研究未探讨能谱CT增强扫描在移行区鉴别中的价值。
综上所述, 能谱CT图像质量优于常规CT, 能够显示恶性骨肿瘤边缘的移行区, 通过能谱曲线斜率的不同可以鉴别肿瘤移行区内的微观浸润及单纯骨髓水肿区。
| [1] |
RAJIAH P, ILASLAN H, SUNDARAM M. Imaging of primary malignant bone tumors (nonhematological)[J]. Radiologic Clinics of North America, 2011, 49: 1135-1161. DOI:10.1016/j.rcl.2011.07.003 |
| [2] |
O'FLANAGAN S J, STACK J P, MCGEE H M, et al. Imaging of intramedullary tumor spread in osteosarcoma. A comparsion of techniques[J]. J Bone Joint Surg Br, 1991, 73(6): 998-1001. |
| [3] |
GOLFIERI R, BADDELEY H, PRINGLE J S, et al. MRI in primary bone tumors: therapeutic implications[J]. European Journal of Radiology, 1991, 12(3): 201-207. DOI:10.1016/0720-048X(91)90073-5 |
| [4] |
ONIKUL E, FLETCHER B D, PARHAM D M, et al. Accuracy of MR imaging for estimating intraosseous extent of osteosarcoma[J]. AJR: American Journal of Roentgenology, 1996, 167(5): 1211-1215. DOI:10.2214/ajr.167.5.8911182 |
| [5] |
李海啸, 胡永成, 黄洪超. MRI在测量恶性骨肿瘤髓内浸润范围及确定合理截骨平面中的作用[J]. 中华关节外科杂志(电子版), 2007, 1(5): 311-317. |
| [6] |
NICOLAOU S, LIANG T, MURPHY D T, et al. Dual-Energy CT: a promising new technique for assessment of the musculoskeletal system[J]. American Journal of Roentgenology, 2012, 199(5, S): S78-S86. |
| [7] |
梁远凤, 李琦, 罗天友. 能谱CT平扫定量分析鉴别诊断周围型肺癌与结核球[J]. 中国医学影像技术, 2017, 33(8): 1206-1210. |
| [8] |
雷立昌, 陈建宇. 能谱CT的临床应用与研究进展[J]. 中国医学影像技术, 2013, 29(1): 146-149. |
| [9] |
安鹏, 张晨颖, 张银霞. 双能量CT在骨骼肌肉系统病变中的应用[J]. 临床放射学杂志, 2019, 38(7): 1139-1142. |
| [10] |
REDDY T, MCLAUGHLIN P D, MALLINSON P I, et al. Detection of occult, undisplaced hip fractures with a dual-energy CT algorithm targeted to detection of bone marrow edema[J]. Emergency Radiology, 2015, 22(1): 25-29. DOI:10.1007/s10140-014-1249-6 |
| [11] |
林晓珠, 沈云, 陈克敏. CT能谱成像的基本原理与临床应用研究进展[J]. 中华放射学杂志, 2011, 45(8): 798-800. DOI:10.3760/cma.j.issn.1005-1201.2011.08.028 |
| [12] |
CHAI J W, CHOI J A, CHOI J Y, et al. Visualization of joint and bone using dual-energy CT arthrography with contrast subtraction: in vitro feasibility study using porcine joints[J]. Skeletal Radiology, 2014, 43(5): 673-678. DOI:10.1007/s00256-014-1817-6 |
| [13] |
LIU X W, OUYANG D, LI H, et al. Papillary thyroid cancer: dual-energy spectral CT quantitative parameters for preoperative diagnosis of metastasis to the cervical lymph nodes[J]. Radiology, 2015, 275(1): 167-176. DOI:10.1148/radiol.14140481 |
| [14] |
COUPAL T M, MALLINSON P I, MCLAUGHLIN P A, et al. Peering through the glare: using dual-energy CT to overcome the problem of metal artefacts in bone radiology[J]. Skeletal Radiology, 2014, 43(5): 567-575. DOI:10.1007/s00256-013-1802-5 |
| [15] |
庞慧婷, 张晓苗, 董越, 等. 年龄和月经状态对成年女性骨盆骨髓ADC值得影响[J]. 中国医学影像技术, 2019, 35(1): 125-128. |
| [16] |
BIERRY G, VENKATASAMY A, KREMER S, et al. Dualenergy CT in vertebral compression fractures: performance of visual and quantitative analysis for bone marrow edema demonstration with comparison to MRI[J]. Skeletal Radiology, 2014, 43(4): 485-492. DOI:10.1007/s00256-013-1812-3 |
 2020, Vol. 56
2020, Vol. 56

