甲状腺乳头状癌是常见的分化型甲状腺癌, 易发生早期淋巴结转移及被膜侵犯, 预后较好[1]。甲状腺乳头状微小癌(PTMC)是指直径<1 cm的甲状腺乳头状癌[2]。目前, 对PTMC是否进行手术干预在医学界仍然存在争议[3]。已有研究表明, 无颈部淋巴结转移(LNM)的PTMC的死亡率<1%, 局部复发率为2%~6%, 远处复发率为1%~2%[1]。2015年的ATA指南不再建议对直径<1 cm但无颈部淋巴结或结外浸润等高风险表现的甲状腺结节进行穿刺, 即使超声声像图的表现可疑[4]。因而, 是否发生LNM是手术与否及手术方式选择的关键。目前大部分研究集中在对甲状腺结节的良恶性判断, 对其淋巴结转移的预测因素评估还非常少。因此, 本研究拟对经手术病理证实的521例PTMC超声声像图及临床特征进行回顾性分析, 以期提高对PTMC病人LNM的预测, 为PTMC病人是否手术治疗及其手术方式选择提供参考。
1 资料与方法 1.1 一般资料2016年4月—2019年4月, 搜集在我院手术并经病理证实且术前均行高频超声检查的甲状腺癌病人(893例)的临床和超声资料, 其中PTMC者521例。521例PTMC中, 男140例(年龄14~67岁, 平均(44.8±19.4)岁), 女381例(年龄11~79岁, 平均(54.1±22.6)岁)。本次研究经医院伦理委员会同意并由病人签署知情同意书。
1.2 仪器与方法采用GE Logic E8型彩色多普勒超声仪, 6~15 MHz宽频线阵探头, 检查时采用甲状腺检查预设值, 病人仰卧位, 充分暴露颈部, 术前均进行常规彩色多普勒超声检查。由5年以上工作经验的超声医师行至少2次(首次发现为第1次, 手术前定位检查为第2次)甲状腺超声检查。如两次检查有差异, 则以术前定位检查结果为准。
1.3 原发灶的超声图像特征观察并记录原发灶的数量、大小、形态、边界、内部回声、血流情况、有无微钙化、侵犯甲状腺被膜、合并结节性甲状腺肿或桥本甲状腺炎等。PTMC通过手术证实为多灶性后, 选择最大的结节进行分析。将结节的内部回声分为实性和囊实混合性。有微钙化定义为结节内全部是微钙化或粗大、微钙化并存, 无微钙化包括结节内无钙化或仅为粗大钙化。形态不规则定义为毛刺样、分叶状生长及纵横长径比>1, 不符合以上两种情况的定义为形态规则。侵犯被膜定义为结节周长与甲状腺被膜接触比例>25%, 反之, 定义为未侵犯甲状腺被膜[5]。结节大小通过诊断性ROC曲线确定最佳临界值。另外, 记录病灶内部有无血流信号, 有无合并结节性甲状腺肿或桥本甲状腺炎等。
1.4 手术方式手术方式依照ATA指南[3]:甲状腺结节为双侧、多发、侵犯被膜、病人有一级亲属家族病史或头颈部放射史, 以及术前评估及术中发现有LNM等, 需行甲状腺全切并双侧中央区淋巴结清扫; 单侧叶单发的病灶, 超声评估无LNM且无家族病史、无头颈部放射史的病人可行甲状腺单侧叶切除及同侧中央区颈淋巴结预防性清扫。
1.5 统计学分析应用SPSS 17.0统计软件进行分析。对PTMC病人的LNM及超声漏诊的中央区颈部淋巴结转移(CLNM)采用ROC曲线选择结节大小的最佳临界值。危险因素分析采用χ2检验和多因素Logistic回归分析。以P < 0.05为差异有统计学意义。
2 结果 2.1 手术方式及超声诊断本研究中283例行甲状腺全切并双侧中央区淋巴结清扫, 227例行甲状腺单侧叶切除及同侧中央区颈淋巴结预防性清扫, 余11例仅行甲状腺侧叶切除术。术前超声发现21例颈侧区淋巴结, 术后病理证实4例为阴性。发生LNM者218例, 未转移303例。在发生转移的218例中超声漏诊149例, 检出69例(其中21例为颈侧区淋巴结), 漏诊率68.3%。
2.2 PTMC病人LNM单因素分析PTMC有无LNM的结节直径的最佳截断值为0.55 cm, 其灵敏度、特异度分别为65.6%、59.6%, 曲线下面积为0.655。原发灶有钙化、被膜有侵犯、形态不规则、有血流、合并结节性甲状腺肿、多灶性、直径≥0.55 cm、病人年龄 < 47岁、男性等与LNM有关, 差异有统计学意义(χ2=7.50~68.97, P均<0.01)。见表 1、图 1。
| 表 1 PTMC病人发生LNM的单因素分析 |
|
|
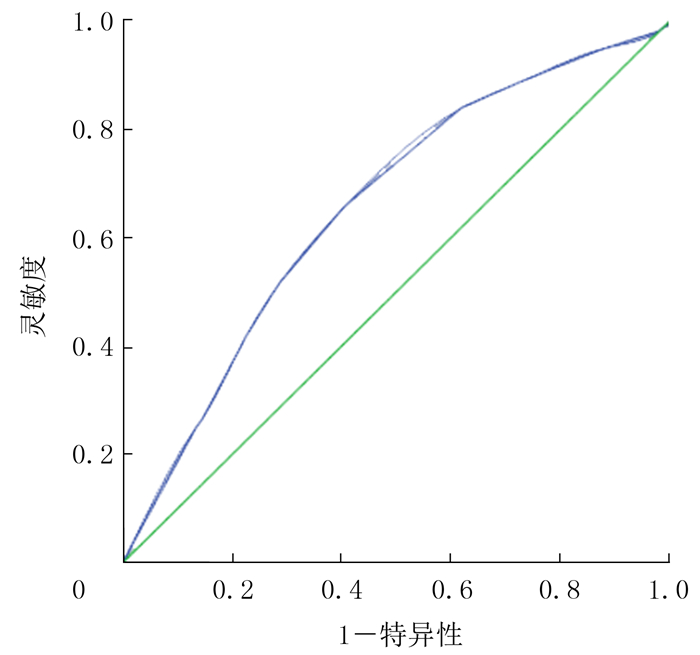 |
| 图 1 LNM的ROC曲线 |
以PTMC淋巴结转移(转移=1, 未转移=0)为因变量, 以单因素分析有统计学意义相关因素为自变量, 进行多因素Logistic回归分析(后退法, α=0.10)。其结果显示, 有被膜侵犯(OR=5.97, 95%CI=3.88~8.02)、有血流(OR=2.88, 95%CI=1.69~3.57)及直径≥0.55 cm(OR=1.86, 95%CI=1.23~3.06)是PTMC淋巴结转移的独立危险因素。
2.4 PTMC超声检查漏诊CLNM的单因素分析PTMC超声漏诊CLNM的结节直径的最佳截断值为0.65 cm, 其灵敏度、特异度分别为66.0%、73.0%, 曲线下面积为0.770。原发灶无钙化、未侵犯甲状腺被膜、单发、直径 < 0.65 cm与超声漏诊CLNM有关, 差异有统计学意义(χ2=5.30~27.70, P均<0.01)。见表 2、图 2。
| 表 2 PTMC病人超声漏诊CLNM的单因素分析 |
|
|
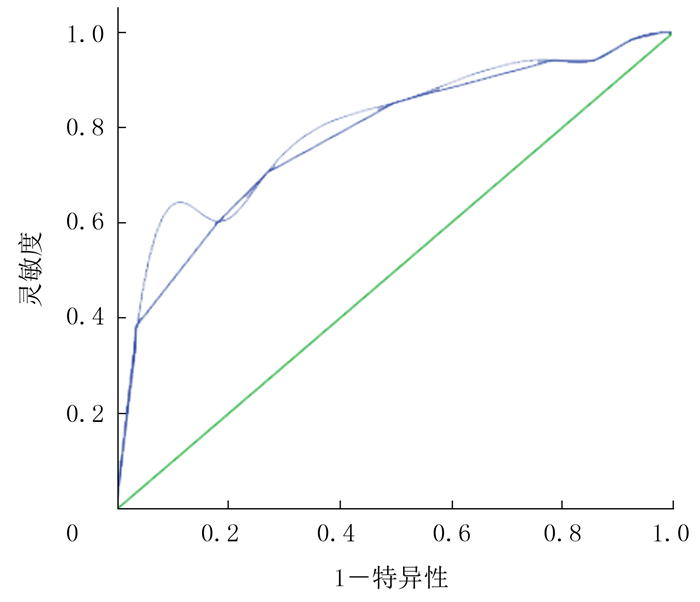 |
| 图 2 超声漏诊CLNM的ROC曲线 |
以超声漏诊CLNM(转移=1, 未转移=0)为因变量, 以单因素分析有统计学意义的因素为自变量, 进行多因素Logistic回归分析(后退法, α=0.10)。研究结果显示, 多灶性(OR=1.33, 95%CI=1.56~3.17)及直径≥0.65 cm(OR=1.26, 95%CI=1.03~2.76)是超声漏诊CLNM的独立危险因素。
3 讨论 3.1 PTMC病人LNM风险因素研究的意义PTMC虽预后良好, 但仍可出现LNM、甲状腺外侵犯及远处转移。根据文献报道, 虽然PTMC体积较小且常为偶然发现, 但其LNM率为3.1%~64.1%, 并且至少有20.0%局部复发的可能[6-7]。这表明, 尽管肿瘤大小是影响疾病预后的重要因素, 但二者并无生物学特征及属性的不同。但过度手术会造成不必要的手术风险及术后并发症, 因而术前超声对LNM的预测尤为重要, 且为手术方式选择提供重要参考和指导。
3.2 原发灶临床及超声特点与LNM的关系影响PTMC淋巴结转移的因素有很多, 本研究中42.0%病人发生LNM, 与其他研究报道结果相似[8]。本研究统计学分析显示, 原发灶侵犯甲状腺被膜、有血流、多灶、直径≥0.55 cm、男性、年龄 < 47岁等与LNM有密切的关系。ZHANG等[8]的研究结果显示, 病人为男性、年龄 < 45岁、结节直径>0.6 cm、被膜侵犯以及多灶等与LNM有关。与本文的结果相似。LEE等[9]研究表明, 原发灶直径>7 mm与LNM有关, 而KIM等[10]则认为原发灶直径>5 mm与LNM有关。本研究采用诊断试验ROC曲线分析表明, 原发灶直径评估淋巴结转移的临界值为0.55 cm, 其灵敏度、特异度分别为65.6%、59.6%。单因素分析结果显示, PTMC最大直径≥0.55 cm与LNM相关, 直径越大越容易发生转移, 这可能是因为, 肿瘤直径越大, 提示肿瘤生长越活跃或存在时间越长。因此, 临床对于原发灶直径≥0.55 cm的病人应做颈部淋巴结探查及清扫, 彻底清除病灶, 避免瘤体及转移淋巴结残留。本研究中有被膜侵犯的病人发生LNM可能性为77.0%, 与VARSHNEY等[11]的研究结果一致。这主要是由于甲状腺被膜是质韧的一层纤维膜, 对防止肿瘤扩散和转移具有重要的保护作用, 一旦被破坏, 说明肿瘤的侵袭能力较强, 且容易累及腺体周围肌肉及其他软组织。因此, 对于PTMC侵犯甲状腺被膜或伴有侵袭性倾向的病例在治疗上应给予更多的重视。甲状腺峡部癌结节多发者易发生LNM, 可能由于左、右叶之间的淋巴管道通过峡部相连, 更容易发生转移[12]。本研究中癌结节多发是影响LNM的因素, 差异有统计学意义。原发灶内有血流更有利于癌细胞的生长和扩散, 因而影响LNM。此外, 病人的年龄 < 47岁、男性也与LNM有密切的关系。
有研究结果表明, 结节边界不清、有微钙化者与LNM有关[4]。但也有学者认为病灶内部回声、钙化、边界、形态等与淋巴结转移无关[13]。本研究结果显示, 结节微钙化、形态不规则、合并结节性甲状腺肿等与LNM有关。有研究结果表明, 有慢性甲状腺炎的PTMC病人发生LNM的概率增高[14-15]。本研究中患有桥本甲状腺炎的69例病人中LNM发生率为35.0%, 较不伴有慢性炎症的病人LNM发生率(43.0%)低, 且差异无统计学意义。
3.3 原发灶临床及超声特点与CLNM漏诊的关系PTMC病人的预后较好, 但是其CLNM发生率为41.0%~64.0%[16]。术前超声检查提示有无LNM具有一定的应用效果[17-19]。但依然有部分病人的LNM在术前超声检查中未能检出, 却在术后病理分析中得到证实。KIM等[14]研究结果显示, 术前超声检查对中央区淋巴结灵敏度为27.3%~55.0%、特异度为69.0%~90.0%, 颈侧区淋巴结灵敏度为65.0%~90.3%、特异度为82.0%~94.8%。本研究中, 在发生转移的218例中超声漏诊149例, 检出69例(其中21例为颈侧区淋巴结), 检出中央区淋巴结的灵敏度、特异度分别为24.4%、97.1%, 颈侧区淋巴结的灵敏度、特异度分别为100.0%、95.1%。可见, 超声漏诊的主要为中央区颈淋巴结, 这主要是因为, 中央区颈淋巴结体积一般比较小, 位置隐蔽, 且回声与甲状腺组织相似, 再加上受到气管、血管、食管等的遮挡, 术前发现率较低。因此, 部分人认为应对中央区颈淋巴结进行预防性清扫, 也有人认为预防性清扫会增加手术风险及术后并发症(尤其是临床及术前超声诊断未提示有淋巴结转移的病人)[20]。因而本文旨在通过研究甲状腺结节的超声声像图及临床特征来预测是否发生CLNM, 进而为临床手术方式的选择提供帮助。
我们对超声漏诊的中央区淋巴结进行了单因素分析, 结果显示, 原发灶有钙化、有被膜侵犯、多灶性者更易发生CLNM, 这与之前结果相似[16-19]。因此, 原发灶大小也是影响超声检出因素之一, 原发灶直径 < 0.65 cm的CLNM检出率(9.9%)明显低于直径≥0.65 cm者(26.2%), 这与KIM等[13]研究相一致。因而对于临床及超声诊断未检出颈部淋巴结但高度可疑, 若发现有甲状腺被膜侵犯、结节直径≥0.65 cm等征象, 应高度警惕是否已发生CLNM, 早期行手术切除及颈部淋巴结清扫。
本研究的局限性:①本研究未采用多中心研究, 病人多来自同一种族、相同环境, 虽有1例外国人, 但病例数太少; ②本研究仅对淋巴结转移的超声声像图及临床特征进行分析, 未进行长期随访, 因此无法评估高频超声特征对肿瘤复发以及病人术后生存率的影响; ③本研究仅做了单因素分析, 未进行多因素分析, 可能会存在因素之间的相互作用, 从而影响最终结果, 尚需进一步研究确认。
总之, 本次研究中影响PTMC的LNM因素有原发灶钙化、侵犯甲状腺被膜、有血流、多灶、伴有结节性甲状腺肿、直径≥0.55 cm、年龄 < 47岁、男性等。影响超声检出CLNM的因素有原发灶无钙化、未侵犯甲状腺被膜、单发及直径 < 0.65 cm等。因此, 在超声检查及临床诊治过程中应重视以上特征, 提高对PTMC的LNM预测, 以期给予临床更多帮助及指导。
| [1] |
JEMAL A, MURRAY T, SAMUELS A, et al. Cancer statistics[J]. JAMA: the Journal of the American Medical Association, 2013, 310(9): 982-1019. DOI:10.1001/jama.2013.5289 |
| [2] |
ZUO H, TANG W, YASUOKA H, et al. A review of 227 cases of small papillary thyroid carcinoma[J]. EJSO, 2007, 33(3): 370-375. DOI:10.1016/j.ejso.2006.09.024 |
| [3] |
American Thyroid Association (ATA) Guidelines Taskforce on Thyroid Nodules and Differentiated Thyroid Cancer, COOPER D S, DOHERTY G M, et al. Revised American thyroid association management guidelines for patients with thyroid nodules and differentiated thyroid cancer[J]. Thyroid, 2009, 19(11): 1167-1214. DOI:10.1089/thy.2009.0110 |
| [4] |
HAUGEN B R, ALEXANDER E K, BIBLE K O, et al. 2015 American Thyroid Association Management Guidelines for Adult Patients with Thyroid Nodules and Differentiatied Thyroid Cancer[J]. Thyroid, 2016, 26(1): 1-133. DOI:10.1089/thy.2015.0020 |
| [5] |
CHOI Y J, YUN J S, KOOK S H, et al. Clinical and imaging assessment of cervical lymph node metastasis in papillary thyroid carcinomas[J]. World Journal of Surgery, 2010, 34(7): 1494-1499. DOI:10.1007/s00268-010-0541-1 |
| [6] |
KWAK J Y, KIM E K, YOUK J H, et al. Extrathyroid extension of well-differentiated papillary thyroid microcarcinoma on US[J]. Thyroid, 2008, 18(6): 609-614. DOI:10.1089/thy.2007.0345 |
| [7] |
KIM H J, YANG J H. Papillary microcarcinoma of the thyroid[J]. Chinese Journal of Clinkal Oncology & Rehabilitation, 2001, 17(10): 488-492. |
| [8] |
ZHANG Ling, WEI Wenjun, JI Qinghai, et al. Risk factors for neck nodal metastasis in papillary thyroid microcarcinoma: a study of 1 066 patients[J]. The Journal of Clinical Endocrinology and Metabolism, 2012, 97(4): 1250-1257. DOI:10.1210/jc.2011-1546 |
| [9] |
LEE K J, CHO Y J, KIM S J, et al. Analysis of the clinicopathologic features of papillary thyroid microcarcinoma based on 7 mm tumor size[J]. World Journal of Surgery, 2011, 35(2): 318-323. DOI:10.1007/s00268-010-0886-5 |
| [10] |
KIM B Y, JUNG C H, KIM J W, et al. Impact of clinicopathologic factors on subclinical central lymph node metastasis in papillary thyroid microcarcinoma[J]. Yonsei Medical Journal, 2012, 53(5): 924-930. DOI:10.3349/ymj.2012.53.5.924 |
| [11] |
VARSHNEY R, PAKDAMAN M N, SANDS N, et al. Lymph node metastasis in thyroid papillary microcarcinoma: a study of 170 patients[J]. Journal of Laryngology and Otology, 2014, 128(10): 922-925. DOI:10.1017/S0022215114001704 |
| [12] |
SALTER K D, ANDERSEN P E, COHEN J I, et al. Central nodal metastases in papillary thyroid carcinoma based on tumor histologic type and focality[J]. Archives of Otolaryngology-Head & Neck Surgery, 2010, 136(7): 692-696. |
| [13] |
KIM K E, KIM E K, YOON J H, et al. Preoperative prediction of central lymph node metastasis in thyroid papillary microcarcinoma using clinicopathologic and sonographic features[J]. World Journal of Surgery, 2013, 37(2): 385-391. DOI:10.1007/s00268-012-1826-3 |
| [14] |
KIM H S, CHOI Y J, YUN J S. Features of papillary thyroid microcarcinoma in the presence and absence of lymphocytic thyroiditis[J]. Endocrine Pathology, 2010, 21(3): 149-153. DOI:10.1007/s12022-010-9124-9 |
| [15] |
LIN Kuailu, WANG Ouchen, ZHANG Xiaohua, et al. The BRAF mutation is predictive of aggressive clinicopathological characteristics in papillary thyroid microcarcinoma[J]. Annals of Surgical Oncology, 2010, 17(12): 3294-3300. DOI:10.1245/s10434-010-1129-6 |
| [16] |
XIANG Yingying, LIN Kuailu, DONG Siyang, et al. Prediction of central lymph node metastasis in 392 patients with cervical lymph node-negative papillary thyroid carcinoma in Eastern China[J]. Oncology Letters, 2015, 10(4): 2559-2564. DOI:10.3892/ol.2015.3544 |
| [17] |
CHEN M, ZHU S L, ZHOU S C. Clinical application of high-resolution ultrasound in diagnosis and differential diagnosis of thyroid carcinoma[J]. Chinese Journal of Medical Ultrasound, 2006, 3(3): 161-163. |
| [18] |
GUO Liying, LU Shen, CHENG Shihua. The high-frequency two-dimensional ultrasonography and color Doppler of neck lymph node metastasis of thyroid carcinoma diagnosis value[J]. Journal of Dalian Medical University, 2007, 23(6): 342-343. |
| [19] |
BONNET S, HARTL D, LEBOULLEUX S, et al. Prophylactic lymph node dissection for papillary thyroid cancer less than 2 cm: implications for radioiodine treatment[J]. The Journal of Clinical Endocrinology and Metabolism, 2009, 94(4): 1162-1167. DOI:10.1210/jc.2008-1931 |
| [20] |
LOMBARDI C P, BELLANTONE R, DE CREA C, et al. Papillary thyroid microcarcinoma:extrathyroidal extension, lymph node metastases, and risk factors for recurrence in a high prevalence of goiter area[J]. World Journal of Surgery, 2010, 34(6): 1214-1221. DOI:10.1007/s00268-009-0375-x |
 2020, Vol. 56
2020, Vol. 56
