小儿胰腺肿瘤较为罕见,仅占所有儿童肿瘤的0.6%~0.8%, 位居小儿胰腺疾病的第3位,发病率位于胰管畸形引起的胰腺疾病和胰腺外伤之后[1]。小儿胰腺肿瘤以胰腺实性假乳头状瘤(SPT)及胰腺母细胞瘤多见,不同病理类型的临床表现不同,手术切除为其主要治疗方法[2-5],预后相差很大。本文回顾性分析我院收治的小儿胰腺肿瘤18例临床资料,旨在探讨不同类型及部位小儿胰腺肿瘤的诊疗方法。
1 临床资料 1.1 一般资料2002年10月—2018年10月,我科收治胰腺肿瘤病儿18例,男6例,女12例;年龄4个月~14岁,平均(8.0±0.3)岁。临床表现为腹痛7例,伴皮肤巩膜黄染3例,外伤后腹痛4例,腹部包块4例。查体触及腹部包块8例。
1.2 术前实验室及影像学检查所有病儿入院后均检查甲胎蛋白(AFP)、癌胚抗原(CEA)、糖类抗原CA199和CA125等肿瘤标志物,除3例胰腺母细胞瘤术前AFP水平显著升高外,其余病儿肿瘤标志物水平均在正常范围内;肝功能、肾功能、空腹血糖及血尿淀粉酶也均处于正常水平。所有病儿均行B超、CT或MRI检查,均发现胰腺不同部位囊实性包块(实性10例,囊实性7例,不均质1例),其中胰头部12例,胰体及胰体尾部交界处6例,伴肝转移1例,合并肝、肠系膜病变1例,胆管扩张5例,合并胰管扩张1例,侵及脾血管或脾门6例。
1.3 诊疗经过本组病儿全部行开放手术治疗。肿瘤位于胰头12例,7例由于肿瘤累及十二指肠引起梗阻、腹痛,3例肿瘤浸润胆总管引起梗阻性黄疸,无法行肿瘤局部切除,故行保留幽门的胰十二指肠切除术;1例肿瘤局限于胰头部(图 1A~C),未侵犯胆总管及胰管,包膜完整,行完整切除术;另1例肿瘤位于胰头,但与十二指肠、结肠粘连紧密,侵犯并包绕胆总管,行肿瘤切除、胆总管空肠ROUX-Y吻合术。肿瘤位于胰体尾部6例,术中探查见肿瘤侵犯脾血管或脾门,行胰体尾+脾切除术(其中肝转移1例,同时行肝脏病灶局部切除术;1例合并肝右叶及肠系膜病变予以同期切除)。
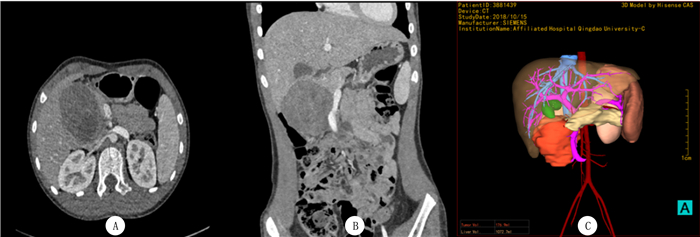 |
| A:胰头部占位强化CT表现;B:肿瘤压迫肠系膜上静脉强化CT冠状位表现;C:计算机辅助手术系统重建得到数字化三维模型,清晰显示肿瘤与毗邻血管的关系。 图 1 局限于胰头部胰腺肿瘤的影像学表现 |
对于较大的胰腺肿瘤,术前应用计算机辅助手术系统进行三维重建,可清晰显示肿瘤与门静脉主干、脾静脉、脾动脉等血管的毗邻关系,基于数字化模型进行手术规划以减少术中血管损伤的发生率。对于胰头部的胰腺肿瘤,可通过三维规划软件自动计算切除后剩余的胰腺体积,从而规划选择最佳手术方式。
1.4 治疗结果本文18例病儿全部顺利完成手术,其中胰十二指肠切除术10例,胰腺尾+脾切除术6例,肿瘤切除术2例,无围手术期死亡。行胰体尾+脾切除术6例病儿术后血小板均有不同程度的升高,给予口服双嘧达莫片(25~50 mg,每日3次)治疗后6周下降至正常。术后病理检查显示:SPT病儿12例,胰腺母细胞瘤3例,胰岛细胞瘤1例,胰腺浆液性囊腺瘤1例,促纤维增生性小圆细胞瘤1例。对18例术后病儿随访至今,每3个月复查病儿的身高、体质量、CT或B超、营养状况、肿瘤标记物、血糖、肝肾功能、血尿淀粉酶等,除1例促纤维增生性小圆细胞瘤病儿术后3年6个月死亡,其余17例均存活且未发现异常。
2 讨论小儿胰腺肿瘤十分罕见,据报道每1.8万例小儿外科手术病儿有1例罹患胰腺肿瘤[6]。有研究报道亚洲人小儿胰腺肿瘤发病率较高,约为0.031‰,其次黑人约为0.021‰,白人少见约为0.015‰[7]。本院收治的18例胰腺肿瘤病儿中,SPT和胰腺母细胞瘤是最常见的小儿胰腺肿瘤,与国外相关研究结果一致[8-11]。
SPT是一种罕见的肿瘤,多数发生于年轻女性并且恶性程度很低,以10岁以上的青春期女孩居多[12-15]。主要表现为非特异性症状,如腹部不适或疼痛,少数可触及腹部包块。SPT是具有非特异性成像特征的罕见肿瘤,超声检查通常表现为较大异质性囊性和实性包块,具有厚的囊和外周钙化。通常,手术切除为SPT的唯一确定性治疗方法,病人总存活率>95%。胰头部肿瘤若累及十二指肠或浸润胆总管,则行保留幽门的胰十二指肠切除术;胰体尾部肿瘤则行远端胰腺切除术,若肿瘤侵犯脾门,则一并行脾脏切除术。如果肿瘤体积较小、位置局限、包膜完整,未侵犯其他部位,可以行肿瘤局部切除或摘除术等胰腺实质保留手术。但必须注意有无胰管损伤及肿瘤残留,防止术后发生胰漏及局部肿瘤复发等并发症。若肿瘤侵犯门静脉或肠系膜上血管甚至有肝局部转移灶,则需同期行肝脏病灶局部切除或肠系膜病变切除术。放疗和化疗在SPT治疗中的作用机制未明,然而,肿瘤的高切除率以及较低的恶性程度可避免进一步进行辅助治疗[16-17]。本研究中胰头部肿瘤10例,累及十二指肠或浸润胆总管,我们借助计算机辅助手术系统进行术前评估,结果显示均可行手术切除,手术方式为保留幽门的胰十二指肠切除术。该术式不仅缩小了手术范围、简化了手术操作,同时缩短了手术时间,减少了出血量,同时完整地保留了胃贮存和消化食物的功能,有利于促进病人术后营养吸收、增加体质量,有效预防倾倒综合征,改善病儿营养状况。
胰腺母细胞瘤是幼儿中最常见的恶性胰腺肿瘤[18-20],也称为胰腺细胞癌,最早由BECKER[21]于1957年描述。有研究表明,男性儿童的胰腺母细胞瘤发病率更高,平均发病年龄约为5岁[22]。胰腺母细胞瘤的临床表现包括腹部包块、腹痛、梗阻性黄疸等,以腹部包块最常见。本组胰腺母细胞瘤病儿3例,有2例因腹部可触及包块就诊,1例因腹痛伴皮肤黄染就诊。胰腺母细胞瘤具有可变性,临床上容易与儿童其他原因导致的腹部大包块相混淆,如神经母细胞瘤、肾母细胞瘤、肝母细胞瘤或非霍奇金淋巴瘤。胰腺母细胞瘤病儿的血清AFP水平通常升高,但在完全切除肿瘤后,病儿的AFP水平均下降并恢复到正常范围。另有研究显示,在无法切除的胰腺母细胞瘤病例中,AFP水平在化疗后逐渐下降[23-24]。这表明血清AFP可作为术前诊断的肿瘤标志物,甚至可以作为评价胰腺母细胞瘤术后治疗效果以及判断是否复发的重要标志。与SPT相比,胰腺母细胞瘤更加异质,并且体积更大,确定起源器官可能更困难。胰腺头部是胰腺母细胞瘤发生的最常见部位,肝脏是其最常见的转移部位[25],其他可能转移的部位为肺和区域淋巴结。由于胰腺母细胞瘤包块巨大,且多位于胰头,因此极易造成对邻近器官的压迫或侵入。手术是其首选治疗方法,完整切除肿瘤可获得最佳预后。肿瘤切除的完整度取决于疾病的范围、位置,以及是否发生转移。其手术方式选择与SPT一致,胰体尾部病变切除可涉及远端胰腺切除术,伴或不伴脾切除术。胰头部病变时需行保留幽门的胰十二指肠切除术(Whipple手术)。尽管胰腺母细胞瘤的复发率很高,但完全切除肿瘤后病儿通常可以长期存活。
胰腺浆液性囊腺瘤又称胰腺浆液性微囊型腺瘤,是一种罕见的胰腺肿瘤,占胰腺外分泌肿瘤1%~2%[8]。胰腺浆液性囊腺瘤多位于胰体和胰尾部,也可见于胰头部。该类肿瘤一般较大,直径2~20 cm,平均为7~13 cm[8]。瘤体多包膜完整,表面光滑,包块一般与胰腺有明显界限,切面显示为由大的单囊或多囊组成的瘤体,囊内含有黏液,有恶变潜能。病儿多因腹部包块就诊,也可因恶心、呕吐、体质量减轻、梗阻性黄疸而就诊。该肿瘤没有明确的肿瘤标志物,需根据病史、体征及影像学检查(B超、CT或MRI)诊断,确诊常需病理检查。由于囊腺瘤术前定性诊断很困难,并有恶变倾向,对化疗和放疗均不敏感,因此手术是唯一的治疗方法。手术方式根据病变部位、性质和侵犯范围可采取肿瘤切除或保留幽门的胰十二指肠切除术[26]。本组1例胰腺钩突肿瘤病儿,术中探查见肿瘤大小约为15 cm×15 cm×12 cm,呈囊实性,内含清亮液体,与结肠、十二指肠、肝脏、胆囊、肝门诸管道粘连紧密,胆总管远端被肿瘤侵及并包绕,行肿瘤切除、胆总管空肠ROUX-Y吻合术,术后病理为浆液性囊腺瘤,手术治疗效果满意。
促纤维增生性小圆细胞瘤更为罕见,其恶性度高、预后极差,瘤细胞可起源于腹、盆腔腹膜及腹外器官,表现为腹腔内多发肉瘤样病变,多见于儿童及青少年[27-28]。本病发病年龄低,治疗效果差,生存率低,具有腹膜及网膜播散倾向,也可血行转移至肝、肺和骨髓等。本组促纤维增生性小圆细胞瘤1例,肿瘤位于胰尾部,侵及肝脏右叶、脾血管,手术行胰尾及肝脏右叶、脾切除术。该病儿手术顺利,术后顺利出院,随访发现其在术后3年6个月死亡。
综上所述,小儿胰腺肿瘤罕见,SPT和胰腺母细胞瘤是最常见的临床类型,临床诊断主要依据就诊症状、腹部B超和CT等辅助检查,手术切除是其治疗的主要手段。由于儿童处于生长发育阶段,消化道的连续性、脾脏的免疫活性和胰腺的内外分泌功能对小儿的生长发育有着至关重要的作用,因此应尽可能缩小切除范围,维持消化道的连续性,保留胃幽门、脾脏和较多正常的胰腺组织。
| [1] |
董蒨. 小儿肿瘤外科学[M]. 北京: 人民卫生出版社, 2009: 6.
|
| [2] |
DALL'IGNA P, CECCHETTO G, BISOGNO G A, et al. Pancreatic tumors in children and adolescents: the Italian TREP project experience[J]. Pediatric Blood & Cancer, 2010, 54(5): 675-680. |
| [3] |
赵铮, 郝增辉, 苗绘, 等. 小儿胰腺实性假乳头状瘤四例临床分析[J]. 中华全科医师杂志, 2017, 16(10): 800-802. DOI:10.3760/cma.j.issn.1671-7368.2017.10.014 |
| [4] |
朱林超, 王旭辉. 小儿胰腺实性假乳头状瘤15例治疗体会[J]. 广东医学, 2016, 37: 103-104. DOI:10.3969/j.issn.1005-4057.2016.01.032 |
| [5] |
王乐, 沈丽萍. 运用达芬奇手术机器人辅助系统治疗小儿胰腺肿瘤[J]. 临床小儿外科杂志, 2018, 17(5): 363-366. |
| [6] |
刘翔琪, 董岿然, 柳龚堡, 等. 保留十二指肠胰头肿块切除术在儿童胰头肿瘤治疗中的应用[J]. 中华小儿外科杂志, 1990, 25(10): 1057-1062. |
| [7] |
GROSFELD J L, VANE D W, RESCORLA F J, et al. Pancreatic tumors in childhood: analysis of 13 cases[J]. Journal of Pediatric Surgery, 1990, 25(10): 1057-1062. DOI:10.1016/0022-3468(90)90218-X |
| [8] |
NASHER O, HALL N J, SEBIRE N J, et al. Pancreatic tumours in children: diagnosis, treatment and outcome[J]. Pediatric Surgery International, 2015, 31(9): 831-835. DOI:10.1007/s00383-015-3727-7 |
| [9] |
BOCHIS O V, BOTA M, MIHUT E, et al. Solid pseudopa- pillary tumor of the pancreas: clinical-pathological features and management of 13 cases[J]. Clujul Medical (1957), 2017, 90(2): 171-178. |
| [10] |
ANTONIOU E A, DAMASKOS C, GARMPIS N, et al. Solid pseudopapillary tumor of the pancreas: a single-center expe- rience and review of the literature[J]. In Vivo (Athens, Greece), 2017, 31(4): 501-510. |
| [11] |
PAZ S M C, DE V J, REVOREDO R F, et al. Pancreatico- duodenectomy for a solid pseudopapillary tumor of the pancreas in children[J]. Revista de Gastroenterologia del Peru, 2017, 37(1): 71-76. |
| [12] |
蒙博, 庞春, 白睿华, 等. 儿童胰腺实性假乳头状瘤12例临床诊治分析[J]. 中华实用儿科临床杂志, 2018, 33(8): 598. DOI:10.3760/cma.j.issn.2095-428X.2018.08.010 |
| [13] |
王建华, 王中秋. 胰腺实性-假乳头状瘤临床研究新进展[J]. 中国临床研究, 2018, 31(11): 158-163. |
| [14] |
史赢, 陈金明, 孟凡宇. 胰腺实性假乳头状瘤的临床诊治分析[J]. 中国现代普通外科进展, 2017, 20(11): 861-864. |
| [15] |
赵雪艳, 张桃桃, 景彩萍, 等. 儿童胰腺实性-假乳头状肿瘤8例临床病理学分析[J]. 诊断病理学杂志, 2018, 25(6): 447-450. DOI:10.3969/j.issn.1007-8096.2018.06.011 |
| [16] |
MAFFUZ A, BUSTAMANTE F D, SILVA J A, et al. Preoperative gemcitabine for unresectable, solid pseudopapillary tumour of the pancreas[J]. Lancet Oncology, 2005, 6(3): 185-186. DOI:10.1016/S1470-2045(05)01770-5 |
| [17] |
GLICK R D, PASHANKAR F D, PAPPO A A. Management of pancreatoblastoma in children and young adults[J]. Journal of Pediatric Hematology Oncology, 2012, 34(2): S47-S50. |
| [18] |
OZCAN H N, OGUZ B, SEN H S, et al. Imaging features of primary malignant pancreatic tumors in children[J]. American Journal of Roentgenology, 2014, 203(3): 662-667. DOI:10.2214/AJR.13.12300 |
| [19] |
SHORTER N A, GLICK R D, KLIMSTRA D S, et al. Malignant pancreatic tumors in childhood and adolescence: The Memorial Sloan-Kettering experience, 1967 to present[J]. Journal of Pediatric Surgery, 2002, 37(6): 887-892. DOI:10.1053/jpsu.2002.32897 |
| [20] |
RAFFEL A, CUPISTI K, KRAUSCH M, et al. Therapeutic strategy of papillary cystic and solid neoplasm (PCSN): a rare non-endocrine tumor of the pancreas in children[J]. Surgical Oncology, 2004, 13(1): 1-6. DOI:10.1016/j.suronc.2003.09.003 |
| [21] |
BECKER W F. Pancreatoduodenectomy for carcinoma of the pancreas in an infant[J]. Annals of Surgery, 1957, 145(6): 864-872. DOI:10.1097/00000658-195706000-00008 |
| [22] |
CAO Liping, LIU Daren. Diagnosis and treatment of panc- reatoblastoma in China[J]. Pancreas, 2007, 34(1): 92-95. DOI:10.1097/01.mpa.0000240610.33936.cb |
| [23] |
OGAWA B, OKINAGA K, OBANA K, et al. Pancreatoblastoma treated by delayed operation after effective chemotherapy[J]. Journal of Pediatric Surgery, 2000, 35(11): 1663-1665. DOI:10.1053/jpsu.2000.18347 |
| [24] |
YONEKURA T, KOSUMI T, HOKIM M, et al. Aggressive surgical and chemotherapeutic treatment of advanced panc- reatoblastoma associated with tumor thrombus in portal vein[J]. Journal of Pediatric Surgery, 2006, 41(3): 598. |
| [25] |
ARGON A, ÇELIK A, ÖNIZ H, et al. Pancreatoblastoma, a rare childhood tumor: a case report[J]. Turk Patoloji Dergisi, 2017, 33(2): 164-167. |
| [26] |
彭承宏, 陈曦. 胰腺良性肿瘤手术治疗方法选择及评价[J]. 中国实用外科杂志, 2008, 28(5): 341-342. DOI:10.3321/j.issn:1005-2208.2008.05.005 |
| [27] |
孙鹏, 徐玉清. 促纤维增生性小圆细胞肿瘤的诊断和治疗[J]. 肿瘤学杂志, 2019, 25(1): 67-70. |
| [28] |
许霄, 张凤春, 徐迎春. 促纤维增生性小圆细胞瘤的治疗进展[J]. 上海交通大学学报(医学版), 2016, 36(5): 747-751, 756. DOI:10.3969/j.issn.1674-8115.2016.05.026 |
 2020, Vol. 56
2020, Vol. 56

