2. 青岛大学附属医院肿瘤科, 山东 青岛 266003
膀胱癌是世界第九大常见恶性肿瘤, 每年新发病例为33万以上, 死亡3万例以上, 其中大约30%为肌层浸润性膀胱癌(MIBC)[1-2]。对于非转移性MIBC及高危非肌层浸润性膀胱癌(NMIBC), 根治性膀胱切除术(RC)加盆腔淋巴结清扫术是其首选的治疗方案[3-4]。淋巴血管侵犯(LVI)指经苏木精-伊红(HE)染色在血管腔或者淋巴管腔内发现肿瘤细胞, 在多种肿瘤的手术标本中LVI可广泛存在, 提示预后不良[5-9]。LVI在多种肿瘤, 如子宫内膜癌、乳癌、肾癌、前列腺癌中的预后价值已被证实, 但LVI对膀胱癌病人预后的影响仍存在争议[10-14]。本研究回顾性分析2011年1—12月于我院泌尿外科行RC的非转移性膀胱癌病人的临床病理资料, 探讨LVI对膀胱癌预后的影响。
1 对象与方法 1.1 研究对象选取2011年1—12月于我院泌尿外科行RC的非转移性膀胱癌病人为研究对象。纳入标准:①行RC且有详细的病理报告; ②术后病理诊断为膀胱尿路上皮癌。排除标准:①术前影像学或者术后病理检查证实已发生淋巴结转移和(或)远处转移的病人; ②合并其他肿瘤的病人。
1.2 研究方法LVI定义为HE染色发现血管腔或者淋巴管腔内出现肿瘤细胞, 所有病理标本均由两位病理医师独立评估, 如存在争议由第3位资深专家协助评估。膀胱癌组织学分级采用世界卫生组织2016年膀胱尿路上皮癌恶性程度分级标准, 膀胱癌肿瘤分期采用国际抗癌联盟2009年TNM分期标准。对所有病人出院后采用电话随访或者门诊随访的方式进行定期随访, 随访截止日期为2016年12月。
1.3 统计学方法采用STATA 12.0统计软件进行数据处理, 计数资料比较采用卡方检验, 采用Kaplan-Meier法评估病人的总生存期(OS)并绘制生存曲线, 采用log-rank检验比较两组OS的差异。采用基于偏最大似然估计的前进法(Forward LR法)筛选自变量, 用Cox比例风险回归模型评估相关危险因素并估计相对风险比(HR)。以P < 0.05为差异有显著性。
2 结果 2.1 LVI与临床病理特征的关系本组共纳入79例病人, 其中男66例, 女13例; 年龄为35~86岁, 中位年龄为66岁。病理分期T1期为39例(49%), T2期24例(30%), T3期10例(13%), T4期6例(8%)。其中合并原位癌(TIS)者2例(3%)。组织学分级低级别5例(6%), 高级别74例(94%)。LVI阳性19例(24%), LVI阴性60例(76%)。LVI阳性病人和阴性者年龄、性别、体质量指数(BMI)、吸烟史、高血压病史、糖尿病病史、肿瘤组织学分级、美国东部肿瘤协作组(ECOG)评分、T分期、是否合并TIS等指标比较, 差异无统计学意义(P>0.05)。见表 1。
| 表 1 LVI阳性与LVI阴性病人临床病理特征的比较(例(χ/%)) |
|
|
本组79例病人随访11.4~63.9个月, 中位随访时间56.9个月, 随访率为87.3%。23例病人死亡, 包括10例LVI阳性病人及13例LVI阴性病人。LVI阳性病人的平均生存时间为43.2个月, LVI阴性病人的平均生存时间为55.6个月, 差异有统计学意义(χ2=8.805, P < 0.05)。见图 1。
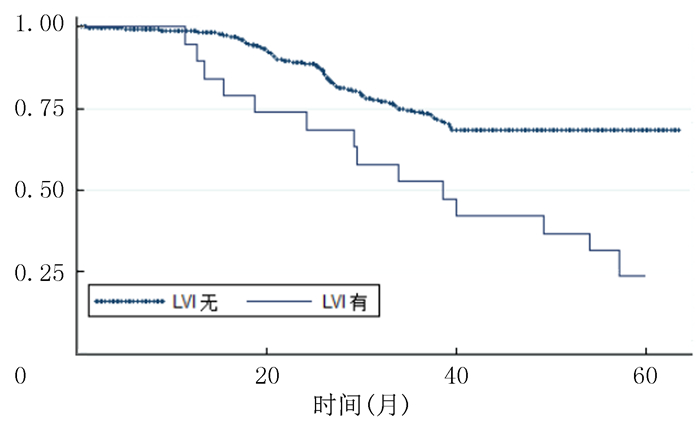 |
| 图 1 Kaplan-Meier法比较RC术后LVI阳性和LVI阴性病人总生存率 |
Cox比例风险回归模型多因素分析结果显示, 年龄(HR=1.025, P < 0.05)、T分期(HR=0.349~11.901, P < 0.05)以及LVI(HR=2.679, P<0.05)是影响OS的独立危险因素, 病人年龄大、T分期高、合并LVI, 则病人预后差; 而性别、吸烟、组织学分级、ECOG评分、辅助放化疗等不是影响OS的独立危险因素(P>0.05)。见表 2。
| 表 2 RC术后病人总生存率Cox比例风险模型多因素分析结果 |
|
|
膀胱癌是最常见的泌尿系肿瘤。尽管近年来膀胱癌的诊断和治疗取得了显著进展, 但目前膀胱癌病人的预后仍不尽人意。研究表明, 与膀胱癌RC术后病人预后相关的因素主要包括肿瘤分期、分级及淋巴结状态[15-17]。但RC术后病人LVI对预后的意义仍有争议。多项研究表明, MIBC病人RC标本中存在LVI可作为独立的危险因素, 与疾病的复发、进展以及OS、RFS密切相关。一项前瞻性研究结果显示, LVI阳性增加了淋巴结阴性膀胱癌病人复发和死亡的风险[18]。BERMAN等[19]研究结果显示, LVI是膀胱癌病人OS和CSS的独立预测因素。一些研究提出了相反的观点, 喻希等[14]研究认为LVI不是膀胱癌复发的独立预测因子[14]。一项纳入了21项研究的Meta分析结果显示, LVI与不良生存结果显著相关, 但在亚洲人群中LVI和无复发生存期无关[20]。这些相反的结果可能是由不同研究组间的遗传及环境的差异引起, LVI的预后价值与地域及人种密切相关, 需要更多同质的研究来证实。
本文回顾性分析了我院79例行RC的非转移性膀胱癌病人的临床资料, 结果显示, LVI阳性率为24.1%。而不同研究LVI阳性率不同, 为15.8%~84.5%[20]。这些研究结果的差异可能是由纳入的人群差异造成的。此外, LVI的确诊需要病理学专家足够的经验和技术。周围组织的回缩伪影增加了诊断的困难, 有专家建议仅报告明确的LVI存在, 必要时使用免疫组化的方法协助诊断[21]。但有一些专家认为免疫组化在LVI的诊断中价值仍存在争议, 不建议常规使用[22-24]。建立严格的组织病理学标准, 使得LVI的诊断具有可重复性是非常重要的[13.25-26]。本研究将LVI定义为HE染色发现血管腔或者淋巴管腔内出现肿瘤细胞, 所有病理标本均由两位病理医师独立评估, 如存在争议由第3位资深专家协助评估随访, 从而保证了诊断的准确性。
本研究结果显示, LVI阳性病人和LVI阴性病人年龄、性别、BMI、吸烟史、高血压病史、糖尿病病史、肿瘤组织学分级、ECOG评分、T分期、是否合并TIS等差异无统计学意义。以往研究结果表明, LVI与病理学T分期、肿瘤分级等不良病理参数有相关性[20, 27-29]。本文结果与其他研究结果不同可能是由于样本量小导致。本研究结果表明, LVI阳性病人的中位生存时间明显低于LVI阴性病人; 多因素分析结果显示, 年龄、T分期、LVI是影响OS的独立危险因素, 表明在亚洲人群中LVI仍然具有评估预后的价值。
本文存在一定的局限性:①本研究为单中心回顾性研究, 存在一定的偏倚, 难以证实因果关系; ②本研究LVI的判断基于HE染色, 存在一定的假阳性及假阴性[19, 25-27]; ③样本量较少, 对部分病人随访时间较短。因此, 需要大规模、多中心、前瞻性的高质量研究, 对LVI的预后价值进行进一步评价。
综上所述, LVI阳性病人的中位生存时间显著低于LV阴性者, LVI是影响行RC的非转移性膀胱癌病人术后OS的独立危险因素。对于该类病人应密切随访, 尽早实施必要的辅助治疗方案, 延长病人的生存期。
| [1] |
WITJES J A, COMPÉRAT E, COWAN N C, et al. EAU guidelines on muscle-invasive and metastatic bladder cancer: summary of the 2013 guidelines[J]. European Urology, 2014, 65(4): 778-792. DOI:10.1016/j.eururo.2013.11.046 |
| [2] |
MATULAY J T, KAMAT A M. Advances in risk stratification of bladder cancer to guide personalized medicine[J]. F1000Research, 2018, 7(F1000 Faculty Rev): 1137. |
| [3] |
ALFRED WITJES J, LEBRET T, COMPÉRAT E M, et al. Updated 2016 EAU guidelines on muscle-invasive and metastatic bladder cancer[J]. European Urology, 2016, 71(3): 462-475. |
| [4] |
张志凌, 周芳坚. 膀胱癌的诊断和治疗进展[J]. 临床外科杂志, 2015, 23(2): 91-92. DOI:10.3969/j.issn.1005-6483.2015.02.004 |
| [5] |
PALMIERI F, BRUNOCILLA E, BERTACCINI A A, et al. Prognostic value of lymphovascular invasion in bladder cancer in patients treated with radical cystectomy[J]. Anticancer Research, 2010, 30(7): 2973-2976. |
| [6] |
LI Bei, XIONG Xianze, ZHOU Yong, et al. Prognostic value of lymphovascular invasion in BismuthCorlette type Ⅳ hilar cholangiocarcinoma[J]. World Journal of Gastroenterology, 2017, 23(36): 6685-6693. DOI:10.3748/wjg.v23.i36.6685 |
| [7] |
CHEN Xiaoli, PU Hong, YIN Longlin, et al. CT volumetry for gastric adenocarcinoma:association with lymphovascular invasion and T-stages[J]. Oncotarget, 2018, 9(15): 12432-12442. |
| [8] |
RYU Y J, KANG S J, CHO J S, et al. Lymphovascular invasion can be better than pathologic complete response to predict prognosis in breast cancer treated with neoadjuvant chemotherapy[J]. Medicine, 2018, 97(30): e11647. DOI:10.1097/MD.0000000000011647 |
| [9] |
袁易初, 黄吉炜, 陈勇辉, 等. 淋巴血管侵犯对行上尿路尿路上皮癌根治术患者预后的影响[J]. 中华泌尿外科杂志, 2017, 38(12): 891-895. DOI:10.3760/cma.j.issn.1000-6702.2017.12.003 |
| [10] |
LUCIC N, DRAGANOVIC D, SIBINCIC S, et al. Myometrium invasion, tumour size and lymphovascular invasion as a prognostic factor in dissemination of pelvic lymphatics at endometrial carcinoma[J]. Medical Archives, 2017, 71(5): 325-329. DOI:10.5455/medarh.2017.71.325-329 |
| [11] |
HAMY A S, GIANG-THANH L, LAAS E, et al. Lymphovascular invasion after neoadjuvant chemotherapy is strongly associated with poor prognosis in breast carcinoma[J]. Breast Cancer Research and Treatment, 2018, 169(2): 295-304. |
| [12] |
FAJKOVIC H, MATHIEU R, LUCCA I, et al. Validation of lymphovascular invasion is an independent prognostic factor for biochemical recurrence after radical prostatectomy[J]. Urologic Oncology: Seminars and Original Investigations, 2016, 34(5): 231-236. |
| [13] |
BEDKE J, HEIDE J, RIBBACK S, et al. Microvascular and lymphovascular tumour invasion are associated with poor prognosis and metastatic spread in renal cell carcinoma: a validation study in clinical practice[J]. BJU International, 2018, 121(1): 84-92. DOI:10.1111/bju.13984 |
| [14] |
喻希, 葛鹏, 王子成, 等. 根治性膀胱切除标本中淋巴血管侵犯的预后判断价值研究[J]. 中华泌尿外科杂志, 2015, 36(2): 122-125. DOI:10.3760/cma.j.issn.1000-6702.2015.02.011 |
| [15] |
ABUFARAJ M, GUST K, MOSCHINI M, et al. Management of muscle invasive, locally advanced and metastatic urothelial carcinoma of the bladder: a literature review with emphasis on the role of surgery[J]. Translational Andrology and Urology, 2016, 5(5): 735-744. DOI:10.21037/tau.2016.08.23 |
| [16] |
徐俊, 杨凯. 膀胱癌术后患者预后影响因素调查研究[J]. 中国现代医生, 2013, 51(2): 7-8, 12. |
| [17] |
王一哲, 黄后宝. 应用Cox模型分析119例膀胱癌患者术后预后因素[J]. 沈阳医学院学报, 2018, 20(1): 23-25. |
| [18] |
VON RUNDSTEDT F C, MATA D A, GROSHEN S, et al. Significance of lymphovascular invasion in organ-confined, node-negative urothelial cancer of the bladder: data from the prospective p53-MVAC trial[J]. BJU International, 2015, 116(1): 44-49. DOI:10.1111/bju.12997 |
| [19] |
BERMAN D M, KAWASHIMA A, PENG Y A, et al. Reporting trends and prognostic significance of lymphovascular invasion in muscle-invasive urothelial carcinoma: a population-based study[J]. International Journal of Urology, 2015, 22(2): 163-170. |
| [20] |
KIM H, KIM M, KWAK C, et al. Prognostic significance of lymphovascular invasion in radical cystectomy on patients with bladder cancer: a systematic review and Meta-analysis[J]. PLoS One, 2014, 9(2): e89259. DOI:10.1371/journal.pone.0089259 |
| [21] |
CHROMECKI T F, BENSALAH K, REMZI M, et al. Prognostic factors for upper urinary tract urothelial carcinoma[J]. Nature Reviews Urology, 2011, 8(8): 440-447. DOI:10.1038/nrurol.2011.96 |
| [22] |
STRAUME O, JACKSON D G, AKSLEN L A. Independent prognostic impact of lymphatic vessel density and presence of low-grade lymphangiogenesis in cutaneous melanoma[J]. Clinical Cancer Research, 2003, 9(1): 250-256. |
| [23] |
MIYATA Y, KANDA S, OHBA K, et al. Tumor lymphangiogenesis in transitional cell carcinoma of the upper urinary tract: association with clinicopathological features and prognosis[J]. Journal of Urology, 2006, 176(1): 348-353. DOI:10.1016/S0022-5347(06)00520-9 |
| [24] |
PADERA T P, KADAMBI A, DI TOMASO E, et al. Lymphatic metastasis in the absence of functional intratumor lymphatics[J]. Science (New York, N.Y.), 2002, 296(5574): 1883-1886. DOI:10.1126/science.1071420 |
| [25] |
李亚县, 张凯忠, 周立. 淋巴血管侵犯对高级别T1期膀胱癌患者初次经尿道膀胱肿瘤电切术预后的影响[J]. 中国医师进修杂志, 2016, 39(10): 910-912. |
| [26] |
李慧, 姜行康, 马宝杰, 等. 淋巴血管侵犯在电切术后高级别T1期膀胱癌中的临床病理意义[J]. 中华泌尿外科杂志, 2015, 36(2): 126-130. DOI:10.3760/cma.j.issn.1000-6702.2015.02.012 |
| [27] |
MATHIEU R, LUCCA I, ROUPRET M, et al. The prognostic role of lymphovascular invasion in urothelial carcinoma of the bladder[J]. Nature Reviews Urology, 2016, 13(8): 471-479. |
| [28] |
ABUFARAJ M, SHARIAT S F, FOERSTER B, et al. Accuracy and prognostic value of variant histology and lymphovascular invasion at transurethral resection of bladder[J]. World Journal of Urology, 2018, 36(2): 231-240. DOI:10.1007/s00345-017-2116-3 |
| [29] |
UKAI R, HASHIMOTO K, NAKAYAMA H, et al. Lymphovascular invasion predicts poor prognosis in high-grade pT1 bladder cancer patients who underwent transurethral resection in one piece[J]. Japanese Journal of Clinical Oncology, 2017, 47(5): 447-452. DOI:10.1093/jjco/hyx012 |
 2020, Vol. 56
2020, Vol. 56

