2. 南方医科大学南方医院妇产科;
3. 南方医科大学病理学系
子宫内膜癌是一种妇科常见的恶性肿瘤,近年来其发病率有明显上升和年轻化的趋势[1-3];尽管以手术为主的综合治疗使子宫内膜癌的治疗效果得到了很大改善,但仍有病人出现转移、复发和耐药等现象,导致预后不佳[4-5]。非受体蛋白质酪氨酸磷酸酶14 (PTPN14)是蛋白酪氨酸磷酸酶家族(PTPs)成员,在调节细胞周期、细胞增殖和侵袭等过程中发挥着重要作用[6-7]。研究指出,PTPN14在胃癌上皮间质转化过程中发挥着重要作用,PTPN14缺失是造成乳腺细胞恶性增殖的重要原因之一[8-9]。目前,关于PTPN14在子宫内膜癌中的作用及机制的研究未见报道。故本研究通过上调PTPN14表达,观察其对子宫内膜癌HEC-1A细胞增殖和凋亡影响,并探讨其可能的作用机制。
1 材料与方法 1.1 主要试剂Opti-MEM培养基、DMEM培养基、LipofectamineTM 2000以及胎牛血清均购于美国Invitrogen公司,PTPN14过表达质粒和阴性对照质粒购于北京普如汀生物技术公司,RNA提取试剂盒、逆转录试剂盒、AnnexinV-PE/7-AAD调亡试剂盒、Trizol裂解液、BCA蛋白检测试剂盒和CCK-8试剂购于南京凯基生物公司,PTPN14单克隆抗体、Yes相关蛋白(YAP蛋白)单克隆抗体、GAPDH单克隆抗体及辣根过氧化物酶标记的羊抗兔/鼠IgG二抗均购于北京中杉金桥公司,引物由上海生工生物工程股份有限公司合成。
1.2 细胞培养和构建PTPN14过表达细胞取保存于本实验室的HEC-1A细胞冷冻管,以温水浴融化后,转移至含有适量DMEM培养基(含体积分数0.10胎牛血清)的离心管中,离心、弃上清。加入DMEM培养基重悬细胞后,再转至培养瓶中,放于设定条件为饱和湿度、37 ℃、含体积分数0.05 CO2的培养箱内预培养。每2 d更新培养基,以光镜观察细胞的生长情况,待细胞几乎完全铺满培养瓶时,进行传代。取对数生长期的HEC-1A细胞,以磷酸缓冲液洗涤细胞后,加入2.5 g/L胰蛋白酶溶液,待细胞从瓶底脱落后,加入培养基(含体积分数0.10胎牛血清)终止消化,细胞计数,以每孔3万个细胞接种至6孔板上,将细胞随机分为空白组(未处理,A组)、阴性组(转染阴性对照质粒,B组)和过表达组(转染PTPN14质粒,C组)。置培养箱内常规培养过夜,次日转染。按照LipofectamineTM 2000说明书操作步骤分别将经Opti-MEM稀释的PTPN14质粒和阴性对照质粒加入过表达组和阴性组细胞,空白组加入等量Opti-MEM。转染6 h后更换培养液,再培养48 h后收集各组对数生长期细胞,采用蛋白质印迹(Western blot)法和定量实时聚合酶链反应(qRT-PCR)分别检测各组细胞中PTPN14蛋白和mRNA,以得到PTPN14过表达的HEC-1A细胞。
1.3 PTPN14蛋白和mRNA检测采用Western blot法检测PTPN14蛋白的表达。收集1.2中转染48 h后的各组细胞,以蛋白裂解液提取总蛋白,BCA法定量其浓度。将60 μg蛋白样品上样至120 g/L的SDS-PAGE凝胶中电泳分离,结束后转PVDF膜。室温下,以50 g/L脱脂奶粉封闭2 h,加入PTPN14(1:800)、GAPDH(1:1 000)一抗,于4 ℃下过夜。TBST洗膜3次后,加入二抗(1:2 000),37 ℃下孵育2 h,洗膜后以ECL显色,Bio-Rad成像仪拍照。采用Image软件计算各组HEC-1A细胞中PTPN14蛋白的相对表达量。每组细胞设3个重复。
用qRT-PCR检测PTPN14 mRNA表达。收集1.2中转染48 h后的各组细胞,以Trizol法提取总RNA,采用逆转录试剂盒合成cDNA。以cDNA为模板,进行PCR扩增。反应体系20 μL:上下游引物各0.5 μL,cDNA模板1 μL,Taq酶0.5 μL,Master Mix 10.5 μL,ddH2O 7.0 μL。反应条件:95 ℃预变性180 s;94 ℃变性30 s,59 ℃退火30 s,72 ℃延伸120 s,35个循环;最后,72 ℃总延伸360 s。以GAPDH作内参基因,2-△△Ct法计算PTPN14 mRNA相对表达量。每组细胞设3个重复。qRT-PCR所用引物及其序列见表 1。
| 表 1 qRT-PCR所用引物及其序列 |
|
|
收集转染48 h的各组细胞,经2.5 g/L胰酶消化后,重悬细胞,以每孔5万个细胞接种到96孔板上,每组设5个复孔。分别于培养箱内培养48、72和96 h后,取培养板弃培养液,向每孔加入CCK-8溶液20 μL。再培养4 h后,应用酶标仪检测,记录各组细胞在450 nm波长处的吸光度(A)值。每组实验重复3次。
1.5 细胞凋亡检测收集1.2中转染48 h后的各组细胞,胰酶消化后,离心弃培养基,经磷酸盐缓冲液洗涤2次,再离心。将7-AAD染液与Binding Buffer以1:10比例混匀后,加入细胞中,避光下充分反应20 min,先加Binding Buffer 450 μL,再加Aimexin V-PE 1 μL混匀,避光反应15 min后,以流式细胞仪进行检测。
1.6 YAP蛋白和mRNA检测收集1.2中转染48 h后的各组细胞,分别用Western blot和qRT-PCR检测各组细胞中YAP蛋白和mRNA的表达情况,具体步骤见1.3。其中,YAP一抗稀释比例为1:500,YAP扩增正向引物序列为5′-CGCTCTTCAACGCCGTCA-3′,反向引物序列为5′-AGTACTGGCCTGTCGGGAGT-3′,退火温度为60 ℃。
1.7 统计学分析使用SPSS 20.0软件进行统计学处理,计量资料数据以x±s表示,组间均数比较采用单因素方差分析,多重比较采用SNK-q检验,两组间比较采用独立样本t检验。以P < 0.05为差异有显著性。
2 结果 2.1 HEC-1A细胞转染检测Western blot和qRT-PCR检测结果表明,A、B和C组间PTPN14蛋白和mRNA表达水平差异有显著性(F=84.336、924.035,P<0.01)。相对于A组,B组细胞中PTPN14蛋白和mRNA表达水平差异无显著性(t=0.657、0.788,P>0.05);C组与A组比较,PTPN14蛋白和mRNA表达水平明显升高(t=10.833、37.554,P<0.01)。见图 1和表 2。
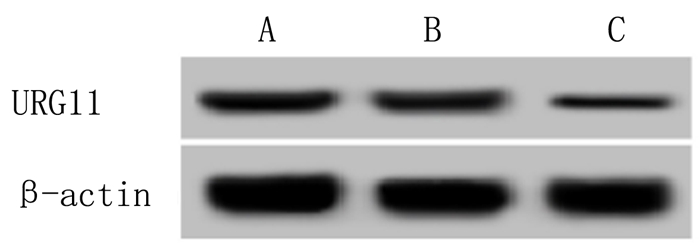 |
| 图 1 各组HEC-1A细胞中PTPN14蛋白表达 |
| 表 2 各组HEC-1A细胞中PTPN14蛋白及mRNA的相对表达量(n=3,x±s) |
|
|
CCK-8法检测结果显示,各组细胞的增殖活力存在显著性差异(F=19.233~87.200,P < 0.01)。与A组比较,同一时间下,C组细胞的增殖活力均明显减弱(t=5.752~12.017,P<0.01),而B组细胞的增殖活力无明显变化(t=0.868~1.265,P>0.05)。见表 3。
| 表 3 过表达PTPN14对子宫内膜癌HEC-1A细胞增殖的影响(n=3,A,x±s) |
|
|
流式细胞术分析结果表明,A组、B组和C组细胞凋亡率分别为(8.28±1.52)%、(9.15±1.36)%和(21.78±3.28)%,组间比较差异有显著意义(F=34.44,P < 0.01)。C组与A组比较差异有显著性(t=7.414,P<0.01),而B组与A组间差异无显著性(t=0.478,P>0.05)。见图 2。
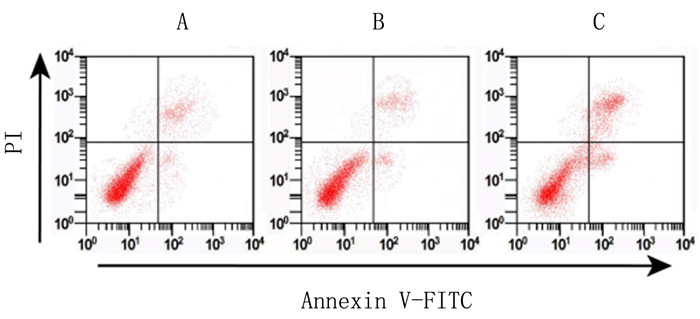 |
| 图 2 流式细胞仪检测各组HEC-1A细胞的凋亡 |
Western blot和qRT-PCR进一步检测结果显示,3组细胞中YAP蛋白和mRNA的表达水平存在显著差异(F=85.605、564.237,P<0.01)。与A组相比较,B组细胞中YAP蛋白和mRNA的相对表达量差异无统计学意义(t=1.032、2.265,P>0.05),而C组细胞中YAP蛋白和mRNA均显著降低,差异均有统计学意义(t=12.293、28.562,P<0.01)。见图 3和表 3。
 |
| 图 3 Western blot检测各组HEC-1A细胞中YAP蛋白的表达 |
| 表 3 过表达PTPN14对各组HEC-1A细胞中YAP蛋白及mRNA的相对表达量(n=3, x±s) |
|
|
PTPs是构成细胞信号转导通路的重要部分,通过蛋白酪氨酸磷酸化参与分子翻译修饰,在生长发育、免疫反应和肿瘤发生等过程中发挥着调节因子的作用[10-12]。PTPN14作为PTPs中的一员,在多种肿瘤细胞中发挥着抑癌基因的作用[13]。有研究发现,在乳癌中敲除PTPN14可通过抑制可溶性膜结合蛋白的转运,促进MDA-MB-231细胞生长和转移;反之,高表达PTPN14可抑制乳癌细胞的增殖能力[14-15]。在食管癌中,转染PTPN14质粒上调EC9706中PTPN14的表达后,细胞周期被阻滞在G1期,细胞增殖明显受到抑制[16]。还有研究结果显示,PTPN14是miR-21的靶基因,下调PTPN14在肝内胆管癌细胞中的表达,细胞增殖得到促进,细胞凋亡受到抑制[17]。目前,子宫内膜癌的发生过程尚不明确,而PTPN14在子宫内膜癌中的作用尚未见报道。本研究通过体外实验的方法,以脂质体法上调PTPN14在子宫内膜癌HEC-1A细胞中的表达,探讨过表达PTPN14对HEC-1A细胞增殖凋亡影响。结果表明,过表达PTPN14能够抑制子宫内膜癌细胞增殖,诱导细胞凋亡。提示PTPN14在子宫内膜癌肿瘤细胞生长过程中发挥着重要作用。
YAP是一种重要的基因转录共激活因子,在Hippo信号通路中发挥着关键作用,通过与转录因子TEAD的结合调控下游基因的表达,发挥着促生长、转移和抑凋亡的重要作用[18-21]。有研究指出,YAP在子宫内膜癌中高表达,与淋巴结转移、整体生存率、组织学分级和预后等密切相关[22],且参与子宫内膜细胞的增殖和上皮间质转化等过程[23-24]。在乳腺上皮细胞中,PTPN14下调能够激活拟表型YAP,并且协同YAP诱导细胞的恶性转化[25]。为了探讨过表达PTPN14抑制子宫内膜癌细胞增殖、诱导细胞凋亡的分子机制,本研究进一步检测过表达PTPN14对HEC-1A细胞中YAP蛋白及mRNA表达的影响。结果表明,过表达PTPN14的HEC-1A细胞中YAP蛋白及mRNA表达水平较对照组均显著降低。结果提示,过表达PTPN14可能通过下调YAP表达发挥着抑制HEC-1A细胞增殖和促进细胞凋亡的作用。
总之,PTPN14在子宫内膜癌的发生发展过程中发挥着重要作用,过表达PTPN14能够抑制子宫内膜癌细胞增殖,诱导细胞凋亡,其作用机制可能与下调YAP表达有关。本研究仅从细胞水平阐述了PTPN14在子宫内膜癌HEC-1A细胞增殖凋亡中的作用,该结果为后续探讨PTPN14在构建的子宫内膜癌裸鼠原位移植模型中的作用打下了基础,并为子宫内膜癌的治疗提供了新的靶点和线索。
| [1] |
李永康, 银铎. 子宫内膜癌淋巴转移的危险因素分析[J]. 中华肿瘤防治杂志, 2016, 23(5): 326-330. |
| [2] |
FERLAY J, SOERJOMATARAM I, DIKSHIT R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. International Journal of Cancer. Journal International du Cancer, 2015, 136(5): E359-E386. DOI:10.1002/ijc.29210 |
| [3] |
廖秦平, 杨曦. 子宫内膜癌筛查及早期诊断的现状及展望[J]. 实用妇产科杂志, 2015, 31(7): 481-484. |
| [4] |
王芳. 子宫内膜癌复发的影响因素分析及相应治疗方案[J]. 实用癌症杂志, 2017, 32(5): 820-822. DOI:10.3969/j.issn.1001-5930.2017.05.039 |
| [5] |
曾靖, 李艳, 金滢, 等. 子宫内膜癌淋巴结转移的危险因素及预后分析[J]. 基础医学与临床, 2017, 37(4): 454-462. DOI:10.3969/j.issn.1001-6325.2017.04.007 |
| [6] |
HAUSCHILD N, BELLE L, KHEW-GOODALL Y, et al. PTPN14 (protein tyrosine phosphatase, non-receptor type 14)[J]. Atlas of Genetics and Cytogenetics in Oncology and Haematology, 2013, 17(7): 462-466. |
| [7] |
CUI T, BELL E H, MCELROY J, et al. miR-4516 predicts poor prognosis and functions as a novel oncogene via targeting PTPN14 in human glioblastoma[J]. Oncogene, 2019, 38(16): 2923. DOI:10.1038/s41388-018-0601-9 |
| [8] |
LIU Y P, SUN X H, CAO X L, et al. MicroRNA-217 suppressed epithelial-to-mesenchymal transition in gastric cancer metastasis through targeting PTPN14[J]. European Review for Medical & Pharmacological Sciences, 2017, 21(8): 1759-1767. |
| [9] |
沈俐萍, 王坤. 曲妥珠单抗治疗前后乳腺癌中USP39、EphA2的表达量及其与肿瘤病理特征的相关性[J]. 海南医学院学报, 2017, 23(10): 1410-1413. |
| [10] |
许云, 章云, 郭晓红, 等. 蛋白酪氨酸磷酸酶SHP2抑制剂的研究进展[J]. 中国药理学与毒理学杂志, 2016, 30(8): 886-892. DOI:10.3867/j.issn.1000-3002.2016.08.014 |
| [11] |
BOLLU L R, MAZUMDAR A, SAVAGE M I, et al. Molecular pathways:targeting protein tyrosine phosphatases in cancer[J]. Clinical Cancer Research, 2017, 23(9): 2136-2142. DOI:10.1158/1078-0432.CCR-16-0934 |
| [12] |
HALE A J, STEEGE E T, HERTOG J D. Recent advances in understanding the role of protein-tyrosine phosphatases in development and disease[J]. Developmental Biology, 2017, 428(2): 283-292. DOI:10.1016/j.ydbio.2017.03.023 |
| [13] |
SZALMAS A, TOMAIC V, BASUKALA O, et al. The PTPN14 tumor suppressor is a degradation target of human papillomavirus E7[J]. Journal of Virology, 2017, 91(7): e00057-17. |
| [14] |
BELLE L, ALI N, LONIC A, et al. The tyrosine phosphatase PTPN14 (Pez) inhibits metastasis by altering protein trafficking[J]. Science Signaling, 2015, 8(364): ra18-ra29. DOI:10.1126/scisignal.2005547 |
| [15] |
吕峰, 于洋, 梁栋, 等. PTPN14对乳腺癌细胞增殖能力的影响[J]. 华中科技大学学报(医学版), 2015, 44(3): 289-293. DOI:10.3870/j.issn.1672-0741.2015.03.010 |
| [16] |
刘华松, 徐兰兰, 张军, 等. PTPN14对食管癌的抑制作用及其机制研究[J]. 中国现代医学杂志, 2017, 27(17): 25-28. DOI:10.3969/j.issn.1005-8982.2017.17.005 |
| [17] |
WANG Lijuan, HE Chenchen, SUI Xin, et al. MiR-21 promotes intrahepatic cholangiocarcinoma proliferation and growth in vitro and in vivo by targeting PTPN14 and PTEN[J]. Oncotarget, 2015, 6(8): 5932-5946. |
| [18] |
WANG Guocan, LU Xin, DEY P, et al. Targeting YAP-dependent MDSC infiltration impairs tumor progression[J]. Cancer Discovery, 2016, 6(1): 80-95. DOI:10.1158/2159-8290.CD-15-0224 |
| [19] |
JIANG Z, ZHOU C, CHENG L, et al. Inhibiting YAP expression suppresses pancreatic cancer progression by disrupting tumor-stromal interactions[J]. Journal of Experimental & Clinical Cancer Research, 2018, 37(1): 69. |
| [20] |
LING H H, KUO C C, LIN B X, et al. Elevation of YAP promotes the epithelial-mesenchymal transition and tumor aggressiveness in colorectal cancer[J]. Experimental Cell Research, 2017, 350(1): 218-225. DOI:10.1016/j.yexcr.2016.11.024 |
| [21] |
DAVID F U, LV X M, HUA G H, et al. YAP regulates cell proliferation, migration, and steroidogenesis in adult granulosa cell tumors[J]. Endocrine-Related Cancer, 2014, 21(2): 297-310. DOI:10.1530/ERC-13-0339 |
| [22] |
李新军, 赵长珍. Yes相关蛋白在子宫内膜癌中的表达及临床病理意义[J]. 国际肿瘤学杂志, 2015, 42(11): 828-831. DOI:10.3760/cma.j.issn.1673-422X.2015.11.008 |
| [23] |
DASARI V R, MAZACK V, FENG W, et al. Verteporfin exhibits YAP-independent anti-proliferative and cytotoxic effects in endometrial cancer cells[J]. Oncotarget, 2017, 8(17): 28628-28640. |
| [24] |
程允. YAP基因在子宫内膜癌中的表达及其与上皮间质转化关系的研究[D].合肥: 安徽医科大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10366-1018122911.htm
|
| [25] |
MICHALOGLOU C, LEHMANN W, MARTIN T A, et al. The tyrosine phosphatase PTPN14 is a negative regulator of YAP activity[J]. PLoS One, 2013, 8(4): e61916-e61924. DOI:10.1371/journal.pone.0061916 |
 2019, Vol. 55
2019, Vol. 55
