2. 青岛大学附属医院肝脏外科, 山东 青岛 266003
肝脏局灶性囊性病变包括单纯性囊肿及复杂囊性病变,多数病人无症状,查体可偶然发现。肝脏局部单纯性囊肿具有典型的超声征象易于诊断,肝脏复杂性囊性病变因病灶内有分隔、壁结节、囊液浑浊等特点,影像学检查常难以做出定性诊断[1]。超声造影(CEUS)检查可以敏感显示肿瘤内的血管,对于肝脏实性病变的诊断不逊于增强CT及MRI[2]。目前,CEUS对于肝脏复杂囊性病变的诊断多局限于单病种报道中,鲜有综合性分析,而肝脏复杂囊性病变良恶性的鉴别诊断仍然是临床工作中的难点。本文回顾性分析我院就诊的56例病人肝脏复杂囊性病变的常规超声和CEUS表现,旨在探讨CEUS检查对于肝脏复杂囊性病变的诊断价值。现将结果报告如下。
1 资料与方法 1.1 一般资料2015年6月—2019年5月,收集在我院就诊的肝脏复杂囊性病变病人56例,男34例,女22例,年龄9~78岁,中位年龄48.5岁。56例病人均为单发病灶。所有病人均接受常规超声检查,其中40例接受CEUS。本研究经过医院医学伦理委员会批准,病人在接受CEUS前均签署知情同意书。本文以病理或临床诊断标准为金标准,评估常规超声及CEUS的应用价值。
1.2 检查方法使用GE Logiq E9、Philipsi U22彩色多普勒超声仪,腹部探头(C5-1)频率1~5 MHz,行常规超声及CEUS检查。常规行肝脏二维灰阶超声和彩色多普勒超声检查,观察肝内病灶位置、大小、形态、边界、内部回声、囊壁、囊内有无分隔,以及分隔的数量与厚度,有无实性部分及囊壁、分隔,实性部分的彩色血流。造影剂采用Bracco公司生产的六氟化硫微泡(SonoVue),使用前向瓶内注入无菌生理盐水5 mL,用力振荡摇匀至冻干粉完全溶解,经肘正中静脉快速推注,剂量为每次1.5~2.0 mL或2.0~2.4 mL,之后快速推注5 mL生理盐水。造影剂注入后连续实时、动态观察病灶内部的灌注过程,观察时间为5 min。动脉期为0~30 s,门脉期为31~120 s,延迟期为121~300 s,并存储整个过程的动态图像,最后将常规超声及CEUS表现与病理及其他临床结果对照分析。由两位从事CEUS工作5年以上超声医师共同分析病灶的增强模式及各时相的造影表现。
1.3 统计学方法应用SPSS 13.0统计软件进行分析。40个行常规超声及CEUS检查的病灶:常规超声考虑为良性的病灶分为Ⅰ类,因有可疑恶性征象不能做出明确诊断的以及考虑为恶性的分为Ⅱ类(可疑恶性征象包括:囊壁厚且不规则、分隔粗细不一、有少量实性成分,有上述征象但无明显血流信号);CEUS考虑为良性的分为Ⅰ类,倾向于恶性的分为Ⅱ类。绘制四格表,计算灵敏度、特异度、准确率、阳性预测值、阴性预测值。采用卡方检验及Fisher精确概率法比较两种方法之间的差异,以P<0.05为差异有统计学意义。
2 结果 2.1 临床诊断本文56例(56个)肝脏复杂囊性病灶,病灶最大径2.7~11.0 cm。良性病灶32个,包括肝脓肿/炎性病变14个,复杂性(出血/感染性)囊肿6个,胆管乳头状黏液腺瘤3个,胆汁瘤3个,间叶性错构瘤2个,胆管错构瘤1个,巨大海绵状血管瘤1个,血肿2个。恶性病灶24个,包括肝转移瘤14个,原发性肝癌6个,黏液性脂肪肉瘤2个,未分化胚胎性肉瘤1个,胆管乳头状黏液腺癌1个。51例经手术或穿刺病理、置管引流证实,5例经CT、MRI证实、临床随访1年以上。
2.2 常规超声表现本文56个病灶中,25个(44.6%)呈多房囊性:9个病灶囊液清亮,16个囊液不清亮,内见细密点状回声及片絮状回声;8个囊壁及分隔上未探及明显血流信号,17个囊壁及分隔均可探及点线状血流信号。21个病灶呈囊实性(37.5%):15个病灶囊液清亮,6个囊液不清亮;实性部分表现不一,11个为较均匀的高回声,10个为不均匀的低回声;14个可探及少许点线状血流信号,7个可探及较丰富的血流信号(其中5个病灶内可探及高阻动脉血流频谱,RI>0.70)。10个病灶呈类囊性(17.9%):超声表现为甚低回声,倾向于囊性,病灶内部未探及明显血流信号。常规超声诊断:考虑良性20个(35.7%),恶性19个(33.9%),误诊6个(10.7%),另外12个(21.4%)未能做出定性诊断。
2.3 CEUS表现本文40个病灶(包括12个常规超声未做出定性诊断)接受CEUS检查,其中20个为囊实性,12个为多房囊性,8个为类囊性。7个类囊性病灶及3个囊实性病灶呈造影三期无增强(图 1A)。17个囊实性、12个多房囊性及1个类囊性病灶的增强特点为:19个病灶囊壁、分隔同步于肝实质增强,11个早于肝实质增强;17个同步于肝实质消退,13个早于肝实质消退。13个囊壁、分隔动脉期呈高增强或等增强,门脉期及延迟期呈等增强;8个囊壁、分隔、实性部分动脉期呈高增强,门脉期呈等增强,延迟期呈低增强(图 1B);9个囊壁、分隔、实性部分动脉期呈高增强,门脉期呈低增强,延迟期呈低增强;其中6个病灶实性部分造影剂灌注不均匀,可见灌注缺损区。所有病灶的囊性部分均无增强。CEUS诊断结果:考虑良性23个(57.5%),恶性17个(42. 5%),误诊3个(7.5%)。
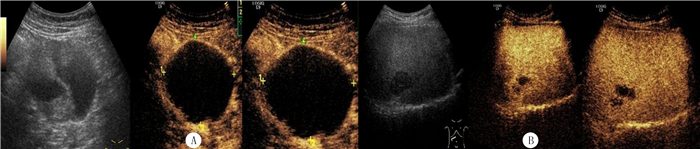 |
| A:常规超声左肝囊实性病灶,CEUS显示病灶无增强,超声引导置管引流,引流液为胆汁。B:常规超声右肝类囊性病灶,CEUS呈囊实性,实性部分动脉期等增强,静脉期等增强,延迟期低增强,超声引导穿刺活检,病理为转移性腺癌。 图 1 肝脏复杂囊性病变的常规超声和CEUS表现 |
常规超声和CEUS诊断肝脏复杂囊性病变良恶性的灵敏度、特异度、准确率、阳性预测值、阴性预测值分别为76.5%、69.6%、65.0%、80.0%、72.5%及94.1%、91.3%、88.9%、95.5%、92.5%,CEUS诊断肝脏复杂囊性病变良恶性的准确率为88.9%,明显高于常规超声,差异有统计学意义(P=0.039)。见表 1。
| 表 1 40个病灶常规超声及CEUS诊断结果比较 |
|
|
肝脏复杂囊性病变病理类型多样:良性病变包括出血性/感染性囊肿、脓肿、寄生虫囊肿、血肿、胆汁瘤、胆管错构瘤、间叶错构瘤、海绵状血管瘤等;恶性病变包括肝癌并囊变、转移瘤、肉瘤等;良恶性兼有的病变包括胆管乳头状黏液性肿瘤、神经内分泌肿瘤等。肝脏复杂囊性病变在常规超声上表现为囊实性、多房囊性、类囊性等3种类型。复杂囊性病变具有以下一种或多种特征:增厚的或者不规则的囊壁、分隔、实性成分、钙化、囊内沉积物等[3]。
常规超声是肝脏病变首选的影像学检查方法,有文献报道,其对于肝脏囊性病变诊断的灵敏度与特异度为90%[4]。但是有些病变不具有典型的声像图特点,常规超声难以鉴别良恶性,需进一步检查明确诊断。CEUS能够实时动态显示病灶内血流灌注情况,提高病变的检出率,并对病变的良恶性进行鉴别。
CEUS能够明确病变的囊性或实性。本组病例中,7例类囊性低回声病灶及3例囊实性病灶,造影三期均呈无增强,3例病灶内部见1~3条纤细分隔增强。CEUS提示囊肿6例,胆汁瘤3例,血肿2例。其中2例手术病理证实为囊肿,3例CEUS后在超声引导下置管引流出褐色胆汁证实为胆汁瘤。5例病人在CEUS检查的同期行CT或MRI检查,检查结果与CEUS相符,符合临床诊断标准,其中4例经常规超声随访1年以上无变化。
良性病变的分隔、囊壁及实性部分在CEUS的门脉期及延迟期呈持续增强,恶性病变造影剂在门脉期快速消退[5]。本组复杂囊性病变良恶性鉴别的难点主要集中在多房囊性及囊实性病灶上。1例78岁男性病人,胰头癌术后3年,常规超声显示右肝囊实性病灶,性质待定。CEUS显示病灶的实性成分在动脉期及门脉期持续增强,延迟期出现造影剂的消退,考虑脓肿。病人在超声引导下于病灶无增强区置管引流脓性液体;在实性区行穿刺活检,病理检查示肝组织呈慢性化脓性炎,并见坏死及脓肿形成。1例67岁女性病人CEUS误诊为肝脓肿,该病人有糖尿病病史,发热1周就诊,血清糖类抗原19-9、癌胚抗原轻度升高,后经超声引导下穿刺活检证实为肝内胆管细胞癌。良恶性病变的CEUS表现常有交叉,与恶性肿瘤比较,炎性病变动脉期增强程度略低,持续时间较短,门脉期和延迟期减退程度低,速度慢,而恶性病变在动脉晚期出现消退,至延迟期消退得更为彻底[6]。CEUS评估病灶良恶性时,应结合病人的肿瘤标志物、其他影像学检查信息综合考虑,必要时可行超声引导下穿刺活检明确诊断。
本组4例胆管内乳头状黏液性肿瘤、2例间叶性错构瘤、1例胆管错构瘤。常规超声表现为多房囊性5例,囊实性2例,其中3例伴有胆管的扩张,提示胆管来源,均未做进一步诊断。胆管内乳头状黏液性肿瘤可表现为胆管不对称性扩张,管腔内见絮状物,探头加压可轻微浮动[7]。CEUS显示胆管内絮状物动脉期增强时,有助于本病的诊断。本组4例胆管内乳头状黏液性肿瘤行CEUS,其中2例延迟期实性区域出现造影剂的消退,提示恶性可能性大,手术病理检查证实为胆管内乳头状黏液腺瘤。CEUS能够判断病灶内的实性成分是肿瘤还是沉积物,但是以造影剂的消退与否鉴别良恶性比较困难,最终需要手术病理证实[8]。常规超声表现为囊性改变的肝转移瘤有胃肠道肿瘤、神经内分泌肿瘤等,转移瘤多在静脉期甚至动脉早期即可表现为低增强。本组1例常规超声为类囊性病变,CEUS为囊实性,病灶的囊壁及分隔在动脉期、静脉期为等增强,延迟期为低增强,结合病史考虑转移瘤,经穿刺活检证实。部分肝癌病人接受肝动脉栓塞及消融治疗后,病灶坏死、液化可呈囊性改变[9],CEUS结合病史,多数不难诊断。肝脏肉瘤少见,较大者合并出血坏死或黏液样变性时,可表现为多房囊性或囊实性,CEUS显示病灶实性部分在延迟期出现造影剂的消退,可提示恶性,最终需穿刺活检或手术病理确诊。
综上所述,CEUS较常规超声更有助于肝脏复杂囊性病变的良恶性的鉴别,可以提高诊断符合率,避免部分病人不必要的进一步检查及手术。对于CEUS表现不典型者,可行超声引导下穿刺活检。本研究的局限性为样本量较小,56例病人中只有40例接受CEUS检查,今后仍需继续积累病例,进行深入研究。
| [1] |
MAVILIA M G, PAKALA T, MOLINA M, et al. Differentiating cystic liver lesions:a Review of imaging modalities, diagnosis and management[J]. Journal of Clinical and Translational Hepatology, 2018, 6(2): 208-216. |
| [2] |
SPOREA I, SIRLI R. Is contrast enhanced ultrasound (CEUS) ready for use in daily practice for evaluation of focal liver lesions?[J]. Medical Ultrasonography, 2014, 16(1): 37-40. DOI:10.11152/mu.2014.2066.161.is1rs2 |
| [3] |
CORVINO A, CATALANO O, SETOLA S V, et al. Contrast-enhanced ultrasound in the characterization of complex cystic focal liver lesions[J]. Ultrasound in Medicine & Biology, 2015, 41(5): 1301-1310. |
| [4] |
MARREO J A, AHN J, RAJENDER R K. ACG clinical guideline:the diagnosis and management of focal liver lesions[J]. The American Journal of Gastroenterology, 2014, 109(9): 1328-1347. DOI:10.1038/ajg.2014.213 |
| [5] |
DUROT I, WILSON S R, WILLMANN J K. Contrast-enhanced ultrasound of malignant liver lesions[J]. Abdominal Radiology, 2018, 43(4): 819-847. DOI:10.1007/s00261-017-1360-8 |
| [6] |
唐小凤, 黄惠, 吴少虹, 等. 肝脏局灶性病变的超声误诊分析[J]. 临床超声医学杂志, 2017, 19(2): 119-122. |
| [7] |
肖静珍, 肖萤, 廖锦堂, 等. 胆管乳头状黏液性肿瘤的超声图像特征[J]. 中华超声影像学杂志, 2017, 26(12): 1039-1041. DOI:10.3760/cma.j.issn.1004-4477.2017.12.006 |
| [8] |
QIAN Lijun, ZHU Jiong, ZHUANG Zhiguo, et al. Spectrum of multilocular cystic hepatic lesions:CT and Mr imaging findings with pathologic correlation[J]. Radiographics:a Review Publication of the Radiological Society of North America, Inc, 2013, 33(5): 1419-1433. DOI:10.1148/rg.335125063 |
| [9] |
RAWLA P, SUNKARA T, MURALIDHARAN P, et al. An updated review of cystic hepatic lesions[J]. Clinical and Experimental Hepatology, 2019, 5(1): 22-29. |
 2019, Vol. 55
2019, Vol. 55
