2. 广州中医药大学第一附属医院肿瘤中心,广东 广州 510006
近期的全球流行病学研究显示,肺癌的发病率及死亡率均排名第一,分别为11.6%和18.4%[1-2]。尽管肺癌的治疗药物不断推陈出新,但是其整体的治疗效果依然有限。预测模型是指用于预测的、用数学语言或公式所描述的事物间的数量关系。在采用定量预测法进行预测时,最重要的工作是建立预测数学模型。在肿瘤学领域中,预测模型的建立是基于队列研究的大量数据,通过对既往数据的分析,综合评价主观(疼痛、疲劳、咳嗽等)和客观(病理分型、基因突变情况、手术与否等)的数据资料,以较为准确地预测病人的预后,为新的诊疗模式提供可靠的参考工具[3-5]。预测模型研究在中医药领域尚处于起步阶段,而有关中西医结合治疗非小细胞肺癌(NSCLC)的预测模型目前尚未建立。因此,本研究将在我院肿瘤中心住院治疗的714例ⅢB~ⅣB期NSCLC病人的数据录入统计软件,并从数据库中筛选变量、建立早期预测模型,以期为中西医结合治疗NSCLC提供疗效预测工具。
1 资料与方法 1.1 队列设计和资料收集本研究为回顾性队列研究设计。纳入我院肿瘤中心2016年6月1日—2018年9月31日经病理检查确诊为NSCLC并接受中西医结合治疗的病人,采集以下相关信息。(1)社会人口学数据和一般情况评价:包括性别、年龄、卡氏评分(KPS评分)、体力状态评分(PS评分)、中医症状评分、中医证型。(2)肺癌诊断资料:包括病理学资料、原发部位、转移部位以及表皮生长因子受体(EGFR)、ALK、ROS-1等基因突变状态。(3)治疗相关数据:包括入组前既往治疗内容和随访资料。①入组前既往治疗内容:手术方式和手术类型;是否接受化疗,化疗方案;是否接受放疗;是否接受靶向治疗,靶向治疗药物的种类;是否接受中医治疗。②随访资料:是否接受化疗,采用何种化疗方案;是否接受放疗;是否接受靶向治疗,采用靶向治疗药物的种类;是否接受中医药治疗。(4)结局数据:是否死亡,死亡原因,是否存在竞争死亡风险。对所有病人进行定期随访(包括嘉禾病历系统随访及电话随访),以死亡作为观察终点。所有未死亡病人在研究时间截止时行电话随访,无法随访(含电话无法接通或病人家属不能配合者)的病人记为失访。中西医结合治疗NSCLC队列设计技术路线见图 1。
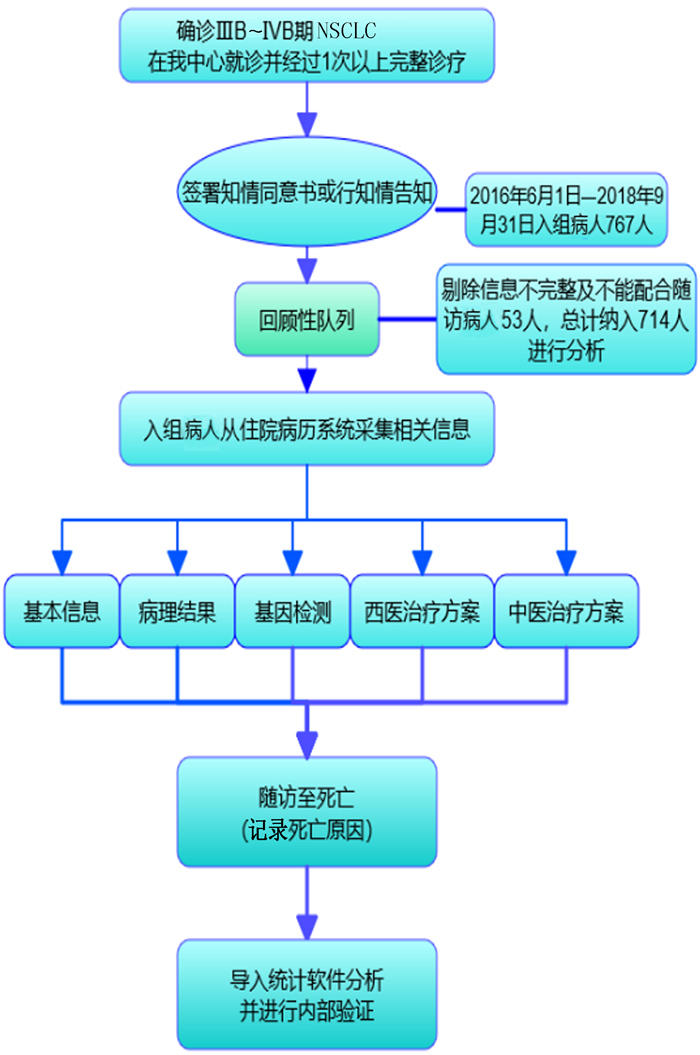 |
| 图 1 中西医结合治疗NSCLC队列设计技术路线图 |
研究数据均由我院肿瘤中心医师或肿瘤专业二年级以上研究生录入,录入人员均接受数据录入系统操作培训,并规定肿瘤分期、治疗方案及疗效评定标准。初始数据录入完成后由数据质控人员重新查阅嘉禾电子病历系统及惠侨检验报告系统检查数据是否出现错漏,数据质控完成后反馈给研究者并要求相关录入人员进行数据修正及说明;数据导出后根据EXCEL表中结果分析数据,查找异常值及缺失值进行二次质控。将以上标准化临床数据录入至我院肿瘤中心的随访数据库(嗵嗵E研,数据库类型为mysql,北京易康医疗科技有限公司,www.s.ttdoc.com)。
1.3 疗效预测模型的建立所有数据使用易侕统计软件(www.empowerstats.com,X&Y solutions,nc. Boston MA)和R语言(http://www.R-project.org)进行处理。剔除部分缺失数据后,将各变量进行单因素Logistic分析。总生存时间(OS)为确诊至死亡的时间。失访者以最后一次随访时间截转;首次入院后不能配合随访者则为删失。生存率计算采用寿命表法,以Kaplan-Meier评价OS和中位生存期。不同方案间的疗效比较采用Log Rank检验,以P<0.05为差异有统计学意义。将单因素分析中P<0.2的变量纳入多元回归分析[6],筛选影响预后的独立危险因素。将多因素分析中P<0.05的变量纳入预测模型制作列线图。建立预测模型的流程:①检查多因素分析筛选的变量中是否有连续性变量,软件模块自动采用多变量分数多项式方法确定每个连续性变量是否要添加多次项,并自动筛除不必要的自变量,输出MFP方法得到的模型;②建立全自变量的预测模型;③运用逐步回归筛选自变量建立简化的模型;④定义自助法次数为500,采用重复抽样的方法,产生500个新样本,分别构建回归模型,计算每个自变量的回归系数的均值。模型建立后通过受试者工作特征曲线(ROC曲线)评估预测区分度,用拟合优度检验法检验模型校准度。
2 结果 2.1 单因素分析及多元回归分析由于EGFR基因突变病人有可选择的靶向药物,不论是腺癌病人还是鳞癌病人都可能有OS的获益[7-10],两者存在交互,因此,作者在对基因突变情况进行多元回归分析时,不调整靶向治疗情况;而在分析靶向治疗情况时,不调整基因突变情况。多元回归分析显示,在调整了化疗、靶向治疗、放疗等因素后,接受中医药治疗依然能降低26%的死亡风险(HR=0.74,95%CI=0.57~0.95,P<0.05),表明中西医结合治疗NSCLC可以延长病人生存期。见表 1。
| 表 1 中西医结合治疗NSCLC单因素分析及多元回归分析 |
|
|
| 表 2 续表 1 |
|
|
将多元回归分析所筛选的变量数据录入软件初步构建预测模型,以75%的数据用于建模,25%的数据用于验证,并进行500次重采样,得到的全自变量列线图见图 2。由图 2可知,模型保留了性别、KPS评分、中医症状评分、中医药治疗、放疗、靶向治疗等6个变量作为预测指标。软件所得预测模型ROC曲线及校准曲线见图 3。由图 3可知,调整后的模型可以预测17.27个月的生存期,曲线下面积(AUC)为0.659,预测的区分度属于中等,当观察到的事件发生率<70%时,黑线在红色参考线上面,低估了风险,且截距大于0.8,校准度一般。
 |
| 图 2 中西医结合治疗NSCLC全自变量列线图 |
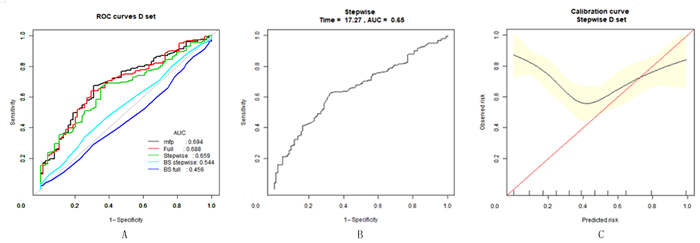 |
| A:初始模型及重采样建模ROC曲线;B:调整后预测模型ROC曲线;C:预测模型校准曲线。 图 3 预测模型的ROC曲线及校准曲线 |
中国的肺癌发病率高于发达国家,中国女性肺癌的发病率高于欧洲国家的女性[1]。研究显示,由于我国女性吸烟人数还没有达到高峰期,故我国女性肺癌的发病率相较于发达国家还有可能继续增加[11-12]。2019年1月,国家癌症中心发布的最新一期全国癌症统计数据显示,全国恶性肿瘤估计新发病例数392.9万,平均每天超过1万人被确诊为癌症,其中肺癌男性发病人数为52万,女性为26.7万[13]。我中心主要接诊广东省的病人,基线资料中男女比例为2.34:1,该比例与全国癌症统计数据接近。
本研究初步单因素分析显示,手术及化疗对于晚期NSCLC病人尽管有一定的保护作用,但差异无统计学意义,因此没有被纳入预测模型中。由本文结果可知,女性的死亡风险低于男性,这是由于女性病人EGFR基因突变情况多于男性[14],可采用的有效治疗药物较多[15-21],所以性别被纳入预测模型。本文结果显示,有机会接受靶向治疗的病人死亡风险降低31%,与不能接受靶向治疗的病人相比差异有显著性,进一步确认了靶向药物治疗的有效性,故在预测模型中也将靶向治疗情况作为预测因子。在列线图的构建中,KPS评分及中医症状评分都被软件自动筛选出来成为预测因子。因此在临床工作中,评估病人的一般体力情况及伴随症状非常重要,这也与临床工作中根据功能状态评分评估是否适宜使用化疗药物一致。本研究中的中医症状评分被纳入到模型中,也证明病人的症状与预后相关。中医症状评分具有预测病人生存情况的潜力,中医症状评分越高,病人的死亡风险越高,中医症状评分每增加1分,病人的死亡风险就增加2.8%。中医药治疗是NSCLC的保护因素,能降低26%的死亡风险,被纳入到预测模型中。本研究结果证明了中医药治疗的有效性,说明中医药协同西医治疗能够为晚期NSCLC病人带来更好的生存获益,这与现有的临床研究结果相近[22-24]。虽然中医证型在预测病人死亡风险中没有统计学差异,但多因素分析结果显示痰热阻肺证相较于肺脾气虚证增加了15%的死亡风险,其原因在于痰热阻肺型NSCLC病人临床多伴有脑转移的情况[25],临床综合治疗效果有限,病人预后不佳[26-27]。
在大数据时代的背景下,建立临床资料数据库,构建预测模型供临床医生参考,可使医生对来诊病人的病情有大致的评估。但是本研究尚存在以下不足:①由于数据平台和规模的限制,本研究为单中心研究,所有病人均来源于广州中医药大学第一附属医院肿瘤中心,病人来源单一容易使预测模型受到地域差异、经济文化水平差异等因素的影响,可能对预测模型的预测能力及所采纳的参考变量产生影响;②本研究数据录入、随访及质控均由我中心人员完成,可能存在部分症状评分录入受到主观影响的情况,从而使列线图变量的界值产生偏差;③由于随访时间有限,可能有潜在的影响因素还没有显现出来。另外,需要说明的是,晚期肺癌的治疗已经迎来了免疫治疗[28-29],但是由于相关的基因检测和免疫药物治疗在我国开展较晚,病人的程序性死亡受体-配体1(PD-L1)表达水平、肿瘤突变负荷(TMB)以及免疫药物使用等数据还没有纳入本次研究。
综上所述,本研究初步建立了中西医结合治疗晚期NSCLC的早期预测模型,这是一次开创性的探索,该模型可以预测17.27个月的生存期,AUC为0.654,可供临床医师研究参考。但模型的区分度属中等水平,说明尚存在部分变量需要完善。在今后的数据采集过程中,我们可以进一步优化检验和影像学系统,扩充表单采集信息,使病人的数据更加完整。并可通过前瞻性队列的数据进一步完善预测模型,使中医药紧跟现代医学发展的趋势,充分发挥中西医结合治疗的优势,惠及更多的病人。
| [1] |
BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA-A Cancer Journal for Clinicians, 2018, 68(6): 394-424. DOI:10.3322/caac.21492 |
| [2] |
FERLAY J, COLOMBET M, SOERJOMATARAM I, et al. Estimating the global cancer incidence and mortality in 2018:GLOBOCAN sources and Methods[J]. International Journal of Cancer, 2019, 144(8): 1941-1953. DOI:10.1002/ijc.31937 |
| [3] |
ZINDLER J D, JOCHEMS A, LAGERWAARD F J, et al. Individualized early death and long-term survival prediction after stereotactic radiosurgery for brain metastases of non-small cell lung cancer:two externally validated nomograms[J]. Radiotherapy and Oncology, 2017, 123(2): 189-194. DOI:10.1016/j.radonc.2017.02.006 |
| [4] |
GAN Wei, HUANG Jinlong, ZHANG Meixia, et al. New nomogram predicts the recurrence of hepatocellular carcinoma in patients with negative preoperative serum AFP subjected to curative resection[J]. Journal of Surgical Oncology, 2018, 117(7): 1540-1547. DOI:10.1002/jso.25046 |
| [5] |
NIEDER C, MEHTA M P, GEINITZ H, et al. Prognostic and predictive factors in patients with brain metastases from solid tumors: a review of published nomograms[J]. Critical Reviews in Oncology Hematology, 2018, 126: 13-18. DOI:10.1016/j.critrevonc.2018.03.018 |
| [6] |
MAO Qixing, XIA Wenjie, DONG Gaochao, et al. A nomogram to predict the survival of stage ⅢA-N2 non-small cell lung cancer after surgery[J]. The Journal of Thoracic and Cardiovascular Surgery, 2018, 155(4): 1784-1792. DOI:10.1016/j.jtcvs.2017.11.098 |
| [7] |
BROWER V. Afatinib and chemotherapy in non-small-cell lung cancer[J]. Lancet Oncol, 2016, 17(2): e47. |
| [8] |
PARK K, TAN E H, O'BYRNE K, et al. Afatinib versus gefitinib as first-line treatment of patients with EGFR mutation-positive non-small-cell lung cancer (LUX-Lung 7): a phase 2B, open-label, randomised controlled trial[J]. Lancet Onco-logy, 2016, 17(5): 577-589. DOI:10.1016/S1470-2045(16)30033-X |
| [9] |
ZUGAZAGOITIA J, FERRER I, PAZ-ARES L. Osimertinib in EGFR-mutant NSCLC:how to select patients and when to treat[J]. The Lancet Oncology, 2016, 17(12): 1622-1623. DOI:10.1016/S1470-2045(16)30506-X |
| [10] |
MAYOR S. Osimertinib effective in EGFR T790M-positive lung cancer[J]. The Lancet Oncology, 2017, 18(1): e9. DOI:10.1016/S1470-2045(16)30654-4 |
| [11] |
TORRE L A, ISLAMI F, SIEGEL R L, et al. Global cancer in women: burden and trends[J]. Cancer Epidemiology, Biomarkers & Prevention: a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, 2017, 26(4): 444-457. |
| [12] |
MOKDAD A H, BALLESTROS K, ECHKO M, et al. The state of US health, 1990—2016: burden of diseases, injuries, and risk factors among US states[J]. JAMA, 2018, 319(14): 1444-1472. DOI:10.1001/jama.2018.0158 |
| [13] |
陈万青, 孙可欣, 郑荣寿, 等. 2014年中国分地区恶性肿瘤发病和死亡分析[J]. 中国肿瘤, 2018, 28(1): 1-14. |
| [14] |
ROSELL R, MORAN T, QUERALT C, et al. Screening for epidermal growth factor receptor mutations in lung cancer[J]. New England Journal of Medicine, 2009, 361(10): 958-967. DOI:10.1056/NEJMoa0904554 |
| [15] |
MAEMONDO M, INOUE A, KOBAYASHI K, et al. Gefitinib or chemotherapy for non-small-cell lung cancer with mutated EGFR[J]. New England Journal of Medicine, 2010, 362(25): 2380-2388. DOI:10.1056/NEJMoa0909530 |
| [16] |
FUKUOKA M, WU Y L, THONGPRASERT S, et al. Biomarker analyses and final overall survival Results from a phase Ⅲ, randomized, open-label, first-line study of gefitinib versus carboplatin/paclitaxel in clinically selected patients with advanced non-small-cell lung cancer in Asia (IPASS)[J]. Journal of Clinical Oncology, 2011, 29(21): 2866-2874. DOI:10.1200/JCO.2010.33.4235 |
| [17] |
GAINOR J F, SHAW A T. J-ALEX: alectinib versus crizoti-nib in ALK-positive lung cancer[J]. Lancet, 2017, 390(189): 3-4. |
| [18] |
HIDA T, NOKIHARA H, KONDO M, et al. Alectinib versus crizotinib in patients with ALK-positive non-small-cell lung cancer (J-ALEX): an open-label, randomised phase 3 trial[J]. Lancet, 2017, 390(189): 29-39. |
| [19] |
PETERS S, CAMIDGE D R, SHAW A T, et al. Alectinib versus crizotinib in untreated ALK-positive non-small-cell lung cancer[J]. The New England Journal of Medicine, 2017, 377(9): 829-838. DOI:10.1056/NEJMoa1704795 |
| [20] |
POPAT S. Osimertinib as first-line treatment in EGFR-mutated non-small-cell lung cancer[J]. The New England Journal of Medicine, 2018, 378(2): 192-193. DOI:10.1056/NEJMe1714580 |
| [21] |
SORIA J C, OHE Y, VANSTEENKISTE J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer[J]. New England Journal of Medicine, 2018, 378(2): 113-125. DOI:10.1056/NEJMoa1713137 |
| [22] |
LIU Jie, LIN Hongsheng, HOU Wei, et al. Comprehensive treatment with Chinese medicine in patients with advanced non-small cell lung cancer: a multicenter, prospective, cohort study[J]. Chinese Journal of Integrative Medicine, 2017, 23(10): 733-739. DOI:10.1007/s11655-016-2737-1 |
| [23] |
YANG Xiaobing, WU Wanyin, LONG Shunqin, et al. Effect of gefitinib plus Chinese herbal medicine (CHM) in patients with advanced non-small-cell lung cancer: a retrospective case-control study[J]. Complementary Therapies in Medicine, 2014, 22(6): 1010-1018. DOI:10.1016/j.ctim.2014.10.001 |
| [24] |
LI T M, YU Y H, TSAI F J, et al. Characteristics of Chinese herbal medicine usage and its effect on survival of lung cancer patients in Taiwan[J]. Journal of Ethnopharmacology, 2018, 213: 92-100. DOI:10.1016/j.jep.2017.10.031 |
| [25] |
孙兴亮, 杜峰, 刘超. 晚期非小细胞肺癌中医证型分布规律及预后探讨[J]. 中医临床研究, 2017, 36(25): 4-6. DOI:10.3969/j.issn.1674-7860.2017.25.002 |
| [26] |
蔡鹏. 同步放化疗与放疗同步联合阿帕替尼治疗Ⅲ期不能手术非小细胞肺癌的临床疗效比较[J]. 实用癌症杂志, 2018, 33(3): 454-457. DOI:10.3969/j.issn.1001-5930.2018.03.032 |
| [27] |
张波, 苏胜发, 欧阳伟炜, 等. 放化疗联合脑转移瘤放疗治疗非小细胞肺癌脑转移的临床疗效分析[J]. 中国癌症防治杂志, 2016, 8(1): 22-26. |
| [28] |
CARBONE D P, RECK M, PAZ-ARES L, et al. First-line nivolumab in stage IV or recurrent non-small-cell lung cancer[J]. The New England Journal of Medicine, 2017, 376(25): 2415-2426. DOI:10.1056/NEJMoa1613493 |
| [29] |
MULLARD A. Immuno-oncology drugs jostle for first-line setting[J]. Nature Reviews Drug Discovery, 2016, 15(11): 738. |
 2019, Vol. 55
2019, Vol. 55

