2. 青岛市第八人民医院药学部, 山东 青岛 266071;
3. 青岛大学附属医院医学研究中心, 山东 青岛 266071;
4. 青岛市市立医院东院肿瘤科, 山东 青岛 266071
随着人们生活水平的提高,心脑血管疾病的发生率逐年增加,已成为引起死亡的重要原因之一。血管功能异常是引起心脑血管疾病的主要原因,其中内皮细胞的功能障碍是血管功能异常的早期事件,在血管功能异常的发生、发展进程中,常伴随一系列的风险因素从而引起内皮细胞的损伤,如血压和高糖血症、血脂异常、吸烟以及肥胖等,这些常见危险因素又与血管内皮细胞氧化损伤引起的功能障碍紧密相关[1-4]。氧化损伤通过直接氧化细胞组成成分中的蛋白质、脂质、核酸等大分子及其他小分子物质,导致内皮细胞的损伤。活性氧(ROS)氧化应激通过激活相关的细胞信号通路调控一系列基因的异常表达,如caspase-3、p53激活等[5-6]。当内皮细胞氧化受损时,充满细胞碎片和粥样硬化斑块积聚在血管内壁上,引起血管腔狭窄,进而导致血管阻塞[7-8]。因此,在发生严重血管粥样硬化之前,使用抗氧化剂进行预处理是预防血管功能异常的良好策略之一。近年来,海洋天然产物因其具有良好的抗氧化活性在营养、制药和化妆品工业中得到了开发和应用[9-10]。深海狭鳕鱼皮是水产加工中的副产品,含有丰富的胶原等蛋白质,本课题组将狭鳕鱼皮经过复合酶液降解得到了抗氧化多肽——狭鳕鱼皮多肽,目前还没有关于狭鳕鱼皮多肽对氧化应激介导的内皮功能障碍作用的报道。本研究拟观察狭鳕鱼皮多肽对H2O2诱导的血管内皮细胞氧化损伤的作用及其机制,为海洋多肽应用提供依据。
1 材料和方法 1.1 材料狭鳕鱼皮多肽粉剂购自青岛福生食品有限公司,其基本的理化指标如下:水分质量分数0.018,灰分质量分数0.004,蛋白质质量分数0.976,羟脯氨酸质量分数0.060;平均分子量为3 000。使用前用细胞培养液完全溶解,现用现配。人脐静脉内皮细胞(HUVECs)由青岛大学附属医院医学研究中心惠赠。超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)试剂盒购自南京建成生物工程公司;过氧化氢(H2O2)、CCK-8检测试剂盒、单溴双胍(mBBr)、Annexin V-FITC细胞凋亡检测试剂盒、WB检测试剂盒以及Caspase-3、P53、Bax、Bcl-2抗体均购自Sigma-Aldrich公司。
1.2 细胞培养及处理HUVECs加入含体积分数0.10胎牛血清的DMEM细胞培养液中培养(含100 kU/L青霉素/链霉素),在含体积分数0.05 CO2培养箱中37 ℃培养,每2 d更换1次培养液,待细胞达到90%左右融合时,用0.5 g/L的胰蛋白酶溶液消化后进行传代培养,取传代3次后的细胞,调整细胞密度为5×106/L用于实验。实验时将细胞分为正常对照组(A组)、模型组(B组)、狭鳕鱼皮多肽低剂量组(C组)、狭鳕鱼皮多肽中剂量组(D组)、狭鳕鱼皮多肽高剂量组(E组)。将HUVECs接种于96孔(每孔100 μL)或24孔培养板(每孔1 mL,测定荧光时用黑色板)中,当细胞达到60%~80%融合时,正常对照组和模型组加正常培养液常规培养,低、中、高剂量狭鳕鱼皮多肽组分别加入60、120、240 mg/L狭鳕鱼皮多肽孵育。6 h后,模型组、各剂量狭鳕鱼皮多肽组均去除培养上清液,再加入100 μmol/L的H2O2培养液继续培养12 h, 然后进行下述实验。每组实验均重复3次。
1.3 检测指标及方法 1.3.1 细胞增殖检测各组细胞经处理后,吸出细胞上清液,加入含体积分数0.10 CCK-8的新鲜培养基,继续培养4 h后,应用多功能微孔板测读仪测定450 nm波长处的吸光度(A),参比波长为600~650 nm。计算细胞增殖率:细胞增殖率(%)=(实验组A-空白组A)/(对照组A-空白组A)×100%。
1.3.2 细胞内谷胱甘肽(GSH)水平测定用mBBr作为荧光硫醇探针测定GSH水平。在上述96孔黑色平板中,各组分别加入30 μmol/L mBBr处理30 min,形成mBBr-GSH荧光结合物,然后在多功能微孔板测读仪上检测,使用激发波长360 nm激发,然后检测发射波长465 nm的荧光强度。
1.3.3 抗氧化酶活性测定在上述24孔培养板中, 各组细胞分别用RIPA缓冲液制备细胞裂解物。应用试剂盒检测细胞抗氧化酶SOD、CAT和GPx活性,按照说明书进行测定。
1.3.4 流式细胞术检测细胞凋亡和坏死采用Annexin V-PI双重染色方法。各组细胞经处理后,离心收集细胞,将细胞悬液置于10 μg/L Annexin V-FITC/PI双染色液中,在室温、避光环境中孵育15 min,然后加入400 μL的结合缓冲液。立即用流式细胞术(BD FACS Caliber system)进行分析。
1.3.5 Western blot检测Caspase-3、P53、Bax及Bcl-2表达采用RIPA缓冲液提取细胞总蛋白,以蛋白检测试剂盒定量上样浓度。将蛋白经100 g/L的SDS-PAGE凝胶电泳分离,转移至PVDF膜上,用含50 g/L脱脂牛奶的TBS-T缓冲液封闭膜后,加入一抗(稀释度Caspase-3为1:200,P53为1:300,Bax为1:300,Bcl-2为1:150)4 ℃孵育过夜,TBS-T洗3次后,进一步与辣根过氧化物酶结合的二抗孵育2 h,然后加ECL化学发光液,用Fluor Chem FC2 Alfaview凝胶成像仪(美国Alpha公司)检测各组蛋白的发光强度,随机软件分析各种蛋白的相对表达量。
1.4 统计学分析应用SAS 9.2软件进行统计学分析,计量数据采用x±s形式表示,多组数据间比较采用单因素方差分析,两两比较采用Dunnet t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 各组HUVECs细胞增殖活性比较正常对照组、模型组、狭鳕鱼皮多肽低剂量组、狭鳕鱼皮多肽中剂量组、狭鳕鱼皮多肽高剂量组细胞增殖活性分别为(100.00±9.42)%、(63.70±5.71)%、(71.62±6.48)%、(84.10±8.33)%和(92.03±6.21)%,模型组细胞增殖活性低于正常对照组,狭鳕鱼皮多肽中、高剂量组细胞增殖活性高于模型组,差异均有显著意义(F=12.04, q=3.39~6.04,P < 0.05)。狭鳕鱼皮多肽各组比较,随着剂量增加细胞增殖活性也增加,组间比较差异有显著性(q=1.90~4.80, P < 0.05)。
2.2 狭鳕鱼皮多肽对抗氧化酶活性和HUVECs氧化能力的影响模型组GSH、SOD、CAT、GPx较正常对照组明显降低,而狭鳕鱼皮多肽中、高剂量组GSH和3种抗氧化酶活性得到显著恢复,各组比较差异均有显著性(F=4.71~43.00, q=3.04~11.00,P < 0.05)。见表 1。
| 表 1 各组HUVECs抗氧化能力指标比较(n=3, x±s) |
|
|
与正常对照组比较,模型组凋亡细胞和坏死细胞均增加;与模型组比较,狭鳕鱼皮多肽低剂量组坏死细胞减少,而凋亡细胞无明显减少;中、高剂量狭鳕鱼皮多肽组坏死细胞和凋亡细胞均较模型组减少,差异均有显著意义(F=7.08、56.90,q′=3.00~19.60,P < 0.05)。见图 1和表 2。
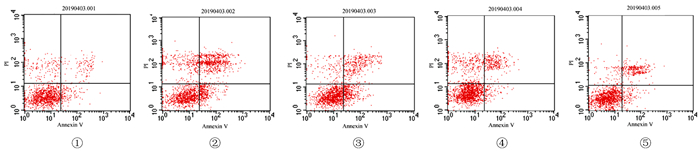 |
| ①A组;②B组;③C组;④D组;⑤E组。 图 1 各组流式细胞术检测结果 |
| 表 2 各组流式细胞术检测结果比较(n=3, χ/%, x±s) |
|
|
模型组P53、Caspase-3及Bcl-2表达较正常对照组升高,狭鳕鱼皮多肽各剂量组Caspase-3、P53、Bax、Bcl-2表达均较模型组降低,且呈剂量依赖性,差异均有显著性(F=37.30~1 508.00,q′=3.70~187.00, P < 0.05)。见图 2和表 3。
 |
| ①A组;②B组;③C组;④D组;⑤E组。 图 2 各组HUVECs凋亡和死亡相关蛋白的表达 |
| 表 3 各组HUVECs凋亡和死亡相关蛋白表达比较(n=3, x±s) |
|
|
内皮损伤和功能障碍被认为是血管粥样硬化发展的早期生物学标志物和血管疾病的一个标志[11]。内皮细胞直接参与血管生物学的多种功能,包括屏障功能、血管稳态、炎症及血管形成和修复等[12-14]。由于氧化应激被认为是血管粥样硬化发病机制的主要原因,降低内皮细胞氧化应激是预防血管粥样硬化发病机制的策略之一[15-18]。
本研究中,模型组细胞经H2O2处理导致细胞存活率显著降低,凋亡升高,狭鳕鱼皮多肽中、高剂量处理可以提高细胞活力和减少HUVECs凋亡,将这种损伤逆转到正常状态。表明狭鳕鱼皮多肽预处理可以保护HUVECs免受H2O2的氧化损伤。ROS在细胞各种功能的调控中起着重要的作用,正常情况下内皮细胞内的稳态可以通过内源性自由基产生(或)抗氧化防御系统来平衡,包括细胞内的抗氧化剂和各种抗氧化酶,如GSH、SOD、CAT、GPx等[19-22]。然而,ROS的过量产生导致氧化剂/抗氧化剂机制失衡,进而导致氧化内皮细胞损伤。GSH是所有细胞中含量最高的抗氧化剂,它可以作为电子供体直接清除自由基,并在ROS还原过程中作为GPx和GST的底物[23-24]。此外,SOD催化超氧化物自由基生成氧或H2O2,然后通过GPx和CAT的催化反应将H2O2分解为水和氧[25]。因此,激活这些抗氧化能力包括抗氧化酶是预防氧化应激引起内皮功能障碍的较佳治疗策略。为了阐明狭鳕鱼皮多肽治疗逆转内皮细胞氧化损伤的潜在机制,本文测定了H2O2诱导的HUVECs损伤中的细胞抗氧化水平。众所周知,给予血管内皮细胞H2O2处理可以刺激ROS的产生,而ROS是细胞凋亡的重要调节因子,可降低细胞抗氧化防御能力[26]。本文结果表明,H2O2诱导HUVECs损伤后抗氧化防御能力较正常对照组显著降低,说明氧化损伤模型复制成功;与模型组相比,狭鳕鱼皮多肽中、高剂量组可提高GSH的内源性抗氧化能力和SOD、CAT、GPx的抗氧化酶活性。这些结果表明,狭鳕鱼皮多肽通过提高细胞抗氧化分子水平来降低氧化应激。
氧化损伤诱导细胞核损伤后,激活与细胞凋亡相关的级联反应。细胞凋亡的分子特点是凋亡信号通路相关特异性基因异常表达,如p53、caspase-3、bcl-2家族成员等,在氧化损伤的细胞中均发生一定程度的表达异常[27-28]。p53与氧化应激诱导的DNA损伤后凋亡的发生密切相关,p53活化导致bax升高,bcl-2表达降低,细胞色素C从线粒体释放。释放的细胞色素C激活下游的caspase-9,随后激活caspase-3诱导凋亡[29-30]。本文研究结果表明,狭鳕鱼皮多肽中、高剂量处理可逆转H2O2诱导的HUVECs损伤的凋亡过程。这种效应是由于p53和caspase-3凋亡基因表达下调以及Bax/Bcl-2比值降低所致。Bax/Bcl-2比值是调控细胞凋亡的重要关键因子,Bax/Bcl-2比值较低可通过激活Caspase-3触发细胞死亡。本文狭鳕鱼皮多肽处理组内皮细胞凋亡率显著降低,提示狭鳕鱼皮多肽处理可能通过调节Bax/Bcl-2比值来抑制凋亡过程。由于Bax/Bcl-2比值影响Caspase-3的活化,本文进一步证实了狭鳕鱼皮多肽预处理可抑制Caspase-3的活化,而Caspase-3是凋亡的关键调控因子,单独给予H2O2处理可使Bax/Bcl-2比值升高,caspase-3基因表达上调;狭鳕鱼皮多肽中、高剂量处理显著降低了H2O2处理的HUVECs中Caspase-3的活化,而Caspase-3活化降低可能是保护细胞免受氧化损伤的主要通路,狭鳕鱼皮多肽通过增强细胞对凋亡刺激的内在耐受来抑制细胞凋亡或死亡。
综上所述,狭鳕鱼皮多肽对H2O2诱导的血管内皮细胞氧化损伤具有明显的保护作用,其作用与狭鳕鱼皮多肽显著提高内皮细胞的抗氧化能力,下调P53,抑制Caspase-3活化并降低Bax/Bcl-2比值,降低细胞凋亡有关。本文结果为利用狭鳕鱼皮多肽保护血管内皮细胞功能提供了依据。
| [1] |
BENJAMIN E J, MUNTNER P, ALONSO A A, et al. Heart disease and stroke statistics-2019 update a report from the American heart association[J]. Circulation, 2019, 139(10): E56-E528. |
| [2] |
India State-Level Disease Burden Initiative CVD Collaborators. The changing patterns of cardiovascular diseases and their risk factors in the states of India:the Global Burden of Disease Study 1990—2016[J]. The Lancet Global Health, 2018, 6(12). DOI:10.1016/s2214-109x(18)30407-8 |
| [3] |
KUTIKHIN A G, YUZHALIN A E, BRUSINA E B, et al. Genetic predisposition to calcific aortic stenosis and mitral annular calcification[J]. Molecular Biology Reports, 2014, 41(9): 5645-5663. DOI:10.1007/s11033-014-3434-9 |
| [4] |
HELLMAN U, MORNER S, HENEIN M. Genetic variants in cardiac calcification in Northern Sweden[J]. Medicine, 2019, 98(15): e15065. DOI:10.1097/MD.0000000000015065 |
| [5] |
KELEK S E, AFSAR E, AKCAY G, et al. Effect of chronic L-carnitine supplementation on carnitine levels, oxidative stress and apoptotic markers in peripheral organs of adult Wistar rats[J]. Food and Chemical Toxicology: an International Journal Published for the British Industrial Biological Research Association, 2019, 134: 110851. DOI:10.1016/j.fct.2019.110851 |
| [6] |
DAI J, CHEN H, CHAI Y. Advanced Glycation End products (AGEs) induce apoptosis of fibroblasts by activation of NLRP3 inflammasome via reactive Oxygen species (ROS) signaling pathway[J]. Medical Science Monitor:International Medical Journal of Experimental and Clinical Research, 2019, 25: 7499-508. |
| [7] |
KIM S M, HUH J W, KIM E Y, et al. Endothelial dysfunction induces atherosclerosis: increased aggrecan expression promotes apoptosis in vascular smooth muscle cells[J]. BMB Reports, 2019, 52(2): 145-150. DOI:10.5483/BMBRep.2019.52.2.282 |
| [8] |
BAR A, TARGOSZ-KORECKA M, SURAJ J, et al. Degradation of glycocalyx and multiple manifestations of endothelial dysfunction coincide in the early phase of endothelial dysfunction before atherosclerotic plaque development in apolipoprotein E/low-density lipoprotein Receptor-Deficient mice[J]. Journal of the American Heart Association, 2019, 8(6): e011171. |
| [9] |
张志慧, 苏秀兰. 生物活性肽在医药领域的研究进展[J]. 中国医药导报, 2019, 16(10): 37-40. |
| [10] |
崔琪, 陈敬蕊, 姜秀云, 等. 海洋生物活性肽及其药物应用研究进展[J]. 中国海洋药物, 2019, 38(2): 54-60. |
| [11] |
MARQUES V B, LEAL M A S, MAGESKI J G A, et al. Chronic iron overload intensifies atherosclerosis in apolipoprotein E deficient mice: role of oxidative stress and endothelial dysfunction[J]. Life Sciences, 2019, 233: 116702. DOI:10.1016/j.lfs.2019.116702 |
| [12] |
王文, 孙芳玲, 刘婷婷, 等. 心脑血管疾病再生与修复治疗研究进展[J]. 神经药理学报, 2018, 8(4): 62-63. |
| [13] |
JUN L W, FOONG C P, ABD HAMID R. Ardisia crispa root hexane fraction suppressed angiogenesis in human umbilical vein endothelial cells (HUVECs) and in vivo zebrafish embryo model[J]. Biomedicine & Pharmacotherapy, 2019, 118: 109221. |
| [14] |
丁美琳, 徐敏, 吴芳, 等. 醛固酮诱导的氧化应激损伤内皮祖细胞介导的血管内皮修复功能[J]. 中山大学学报(医学版), 2018, 39(6): 818-826. |
| [15] |
ZHANG N, ZHANG Y, ZHAO S, et al. Septin4 as a novel binding partner of PARP1 contributes to oxidative stress induced human umbilical vein endothelial cells injure[J]. Cardiovascular Toxicology, 2018, 496(2): 621-627. |
| [16] |
MAJER M, GACKOWSKI D, ROZALSKI R, et al. Systemic oxidoreductive balance and vascular function in individuals without clinical manifestation of atherosclerosis[J]. Archives of Medical Sciences Atherosclerotic Diseases, 2017, 2: e37-e45. DOI:10.5114/amsad.2017.70501 |
| [17] |
KIM H, YUN J, KWON S M. Therapeutic strategies for oxidative stress-related cardiovascular diseases: removal of excess reactive oxygen species in adult stem cells[J]. Oxid Med Cell Longev, 2016, 2016: 2483163. |
| [18] |
HAYBAR H, SHAHRABI S, REZAEEYAN H, et al. Endothelial cells: from dysfunction mechanism to pharmacological effect in cardiovascular disease[J]. Cardiovascular Toxicology, 2019, 19(1): 13-22. DOI:10.1007/s12012-018-9493-8 |
| [19] |
HUANG Meizhou, YANG Yajun, LIU Xiwang, et al. Aspirin eugenol ester attenuates oxidative injury of vascular endothelial cells by regulating NOS and Nrf2 signalling pathways[J]. British Journal of Pharmacology, 2019, 176(7): 906-918. DOI:10.1111/bph.14592 |
| [20] |
DOBI A, BRAVO S B, VEEREN B A, et al. Advanced glycation end-products disrupt human endothelial cells redox ho-meostasis: new insights into reactive Oxygen species production[J]. Free Radical Research, 2019, 53(2): 150-169. DOI:10.1080/10715762.2018.1529866 |
| [21] |
FARAG M R, ALAGAWANY M, ABD EL-HACK M E. Yucca schidigera extract modulates the lead-induced oxidative damage, nephropathy and altered inflammatory response and glucose homeostasis in Japanese quails[J]. CNS Neuroscience & Therapeutics, 2018, 156: 311-321. |
| [22] |
XIE Yanzhao, ZHANG Xiangjian, ZHANG Cong, et al. Protective effects of leonurine against ischemic stroke in mice by activating nuclear factor erythroid 2-related factor 2 pathway[J]. CNS Neuroscience & Therapeutics, 2019, 25(9): 1006-1017. |
| [23] |
LEE D S, JO H G, KIM M J, et al. Antioxidant and anti-stress effects of taurine against electric foot-shock-induced acute stress in rats[J]. Advances in Experimental Medicine and Biology, 2019, 1155: 185-196. |
| [24] |
CEYLAN H, BUDAK H, KOCPINAR E F, et al. Examining the link between dose-dependent dietary iron intake and Alz-heimer's disease through oxidative stress in the rat cortex[J]. Journal of Trace Elements in Medicine and Biology: Organ of the Society for Minerals and Trace Elements (GMS), 2019, 56: 198-206. DOI:10.1016/j.jtemb.2019.09.002 |
| [25] |
JARIKRE T A, TAIWO J O, EMIKPE B O, et al. Protective effect of intranasal peste des petits ruminants virus and bacterin vaccinations: clinical, hematological, serological, and se-rum oxidative stress changes in challenged goats[J]. Veterinary World, 2019, 12(7): 945-950. DOI:10.14202/vetworld.2019.945-950 |
| [26] |
PARK C, CHA H J, CHOI E O, et al. Isorhamnetin induces cell cycle arrest and apoptosis via reactive oxygen species-me-diated AMP-activated protein kinase signaling pathway activation in human bladder cancer cells[J]. Cancers, 2019, 11(10): 1494. DOI:10.3390/cancers11101494 |
| [27] |
RAJAVEL T, BANU PRIYA G, SURYANARAYANAN V, et al. Daucosterol disturbs redox homeostasis and elicits oxidative-stress mediated apoptosis in A549 cells via targeting thioredoxin reductase by a p53 dependent mechanism[J]. European Journal of Pharmacology, 2019, 855: 112-123. DOI:10.1016/j.ejphar.2019.04.051 |
| [28] |
NEVES S P, DE CARVALHO N C, DA SILVA M M, et al. Ruthenium complexes containing heterocyclic thioamidates trigger caspase-mediated apoptosis through MAPK signaling in human hepatocellular carcinoma cells[J]. Frontiers in Oncology, 2019, 9: 562. DOI:10.3389/fonc.2019.00562 |
| [29] |
MARTINEZ M A, JOSE-LUIS RODRIGUEZ I A, ROURA-MARTINEZ D, et al. Pyrethroid insecticide lambda-cyhalothrin induces hepatic cytochrome P450 enzymes, oxidative stress and apoptosis in rats[J]. Science of the Total Environment, 2018, 631: 1371-1382. |
 2019, Vol. 55
2019, Vol. 55

