2. 青岛市市立医院产三科, 山东 青岛 266071;
3. 青岛市第三人民医院呼吸科, 山东 青岛 266071
肺癌是最常见的恶性肿瘤之一,同时也是全球恶性肿瘤死亡的主要原因[1-2],其中非小细胞肺癌(NSCLC)占所有肺癌的80%以上[3]。NSCLC目前的主要治疗方法是手术、放疗和化疗,尽管放疗和化疗的应用使NSCLC预后得到很大改善,但其生存率还是很低[4],所以NSCLC的靶向研究显得尤为重要。近年来研究结果发现,miRNA对肺癌的进展、诊断以及治疗起着关键作用,其在肺癌的治疗研究中备受关注[5]。miRNA是一类长约20个氨基酸的小RNA,它可以与特定的靶点结合,影响靶位点的mRNA翻译,进而影响相关蛋白的表达[6]。有研究表明,miRNA-375(miR-375)与肿瘤的侵袭、转移和凋亡有着密切的联系,而且miR-375的表达与癌症病人的总生存率相关,所以推测miR-375可能是一种有用的临床预后生物标志物[7-8]。JUNG等[9]研究发现,MYC可以受miR-375的调节进而影响肿瘤的进展和表型。MYC家族包括C-MYC、N-MYC和L-MYC,对肿瘤细胞的侵袭、迁移都有很重要的作用[10-11]。已有研究表明,一些药物可以通过抑制MYC通路的激活来抑制人宫颈癌细胞的增殖、迁移和上皮间质转化(EMT)[12];hsa-miR-24则可以通过调节c-MYC/EMT轴来抑制鼻咽癌细胞的转移能力[13];MYC还可以通过抑制RPS19/EMT信号传导的激活来抑制癌细胞的转移[14]。本研究旨在探讨miR-375是否可通过MYC/EMT对NSCLC的侵袭和迁移产生影响。
1 材料与方法 1.1 细胞与样本所用NSCLC细胞(A549)和正常肺组织细胞(BEAS-2B)由青岛大学博雅楼实验室冻存。A549细胞用RPMI-1640(HyClone,美国)培养液培养,BEAS-2B细胞用LHC-9(HyClone,美国)培养液培养,培养细胞时两种培养液都加入体积分数0.10胎牛血清(索莱宝,北京)。含EDTA的胰蛋白酶(索莱宝,北京)用于消化贴壁细胞。NSCLC组织和癌旁组织的新鲜样本各30例,来自青岛市市立医院。本研究的组织来源病人均签署了书面同意书,研究获青岛大学附属医院伦理委员会批准。
1.2 细胞转染将A549细胞接种于96孔板中,每孔10 000个,置于含体积分数0.05 CO2的37 ℃培养箱中培养24 h。实验共分3组,在96孔板中未做任何处理的A549细胞作为空白组,将转染含空载体慢病毒(吉凯基因公司,上海)的A549细胞作为对照组,将转染表达miR-375慢病毒(吉凯基因公司,上海)的A549细胞作为实验组。将3组细胞置于培养箱继续培养10 h后,移除96孔板中的培养液,更换新的培养液,每孔100 μL。然后继续培养72 h,应用实时荧光定量PCR(qRT-PCR)技术检测3组细胞中miR-375的表达量。
1.3 qRT-PCR收集长势良好的细胞,按照iso plus RNA提取试剂盒(Takara,日本)的说明书提取3组细胞的总RNA,用PrimeScript RT reagent Kit with gDNA Eraser(Perfect Real Time)(Takara,日本)将RNA反转成cDNA,使用SYBR Premix Ex Taq RR420A(Takara,日本)进行qRT-PCR,检测细胞中miR-375的表达。反应条件:95 ℃、30 s;95 ℃、5 s,60 ℃、30 s,40个循环;60 ℃、15 s。实验所用引物均购自上海生工,其中U6作为miRNA-375的内源性参照。引物序列见表 1。
| 表 1 qRT-PCR引物序列 |
|
|
① 迁移实验:向24孔板(康宁,美国)的3个孔中加入含体积分数0.15胎牛血清的培养液,每孔500 μL,将3个Transwell小室(康宁,美国)分别放入3个孔中。取3组细胞各5×104个分别接种于以上3个Transwell小室内,置于细胞培养箱中培养24 h后取出,用棉签擦拭3个Transwell小室的内膜,之后小室用甲醇溶液固定10 min,用甲紫染色10 min,PBS洗3次,拍照,在显微镜下计数细胞。②侵袭实验:将基质胶(康宁,美国)与完全培养液按1:9的比例稀释,将稀释后的混合液按每孔100 μL加入Transwell小室中,置于37 ℃培养箱中4 h,其余实验步骤同迁移实验。
1.5 Western blot检测取3组细胞,用PBS洗2次后加入1 mL的PBS,使用细胞刮刀将细胞刮下分别放入3个离心管中,以5 000 r/min离心5 min。去上清留细胞沉淀,在细胞沉淀中加入细胞裂解液和蛋白酶抑制剂,冰上裂解30 min,以12 000 r/min离心10 min,上清即为总蛋白。将提取的蛋白质加入上样缓冲液SDS-Loading Buffer,沸水浴煮5 min。取45 μg蛋白置SDS-PAGE凝胶中电泳,电泳结束后将胶中的蛋白条带转移到PVDF膜上(Millipore,美国)。用脱脂奶粉封闭2 h,在4 ℃下与MYC(1:1 000,CST)、β-actin(1:3 000,Bioss)、E-钙黏蛋白(E-cadherin,1:1 000,CST)、波形蛋白(Vimentin,1:1 000,CST)的一抗一起孵育过夜;加入二抗(1:1 000,Abcam)低速振荡60 min。用超敏型化学发光底物试剂(ECL)进行蛋白条带成像,分析条带灰度值,计算各蛋白相对表达量。
1.6 统计学方法采用SPSS 19.0软件进行统计学分析,计量资料结果以x±s形式表示,两组间比较采用配对t检验,多组间比较采用方差分析。以P<0.05表示差异有显著性。
2 结果 2.1 miR-375的表达 2.1.1 NSCLC组织和癌旁组织miR-375表达的比较癌旁组织和NSCLC组织miR-375的相对表达量分别为0.40±0.20和1.00±0.03,NSCLC组织miR-375的表达明显高于癌旁组织,差异有显著性(t=16.88,P<0.05)。
2.1.2 BEAS-2B细胞和A549细胞miR-375表达的比较BEAS-2B细胞和A549细胞miR-375的相对表达量分别为1.00±0.02和2.20±0.30,A549细胞miR-375的表达明显高于BEAS-2B细胞,差异有统计学意义(t=8.51,P<0.05)。
2.1.3 各组细胞miR-375表达的比较实验组细胞miR-375的表达较空白组和对照组明显增加,差异有显著性(F=1 677.95,P<0.05),而空白组和对照组比较差异无统计学意义(P>0.05)。见表 2。
| 表 2 miR-375对NSCLC细胞miR-375表达及侵袭和迁移能力的影响(n=3, x±s) |
|
|
与空白组和对照组相比,实验组细胞的迁移、侵袭能力均增强,差异有显著意义(F=90.21、29.55,P<0.05),而空白组和对照组比较差异无统计学意义(P>0.05)。见表 2。
2.3 miR-375对MYC蛋白表达的影响与空白组和对照组相比,实验组细胞MYC的表达增加,差异有显著意义(F=37.15,P<0.05),而空白组和对照组比较差异无统计学意义(P>0.05)。见表 3。
| 表 3 miR-375对MYC蛋白和EMT相关蛋白表达的影响(n=3, x±s) |
|
|
与空白组和对照组相比,实验组细胞E-cadhe-rin的表达降低,Vimentin的表达升高,差异均有显著性(F=47.25、77.64,P<0.05),而空白组和对照组E-cadherin和Vimentin的表达比较差异无统计学意义(P>0.05)。见图 1和表 3。
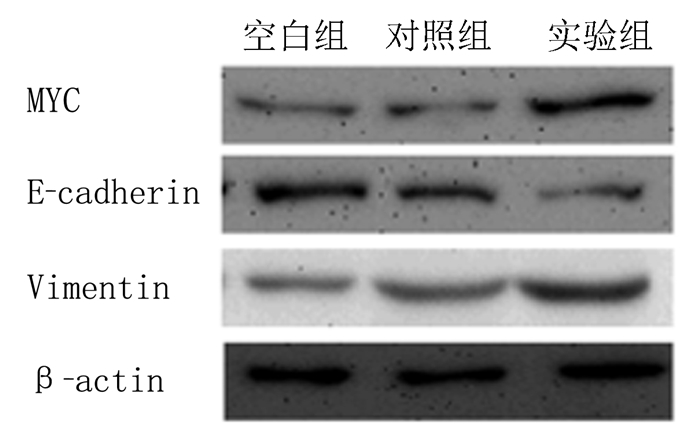 |
| 图 1 各组细胞MYC蛋白以及EMT相关蛋白表达的Western blot检测 |
肺癌是全球范围内很常见的一种肿瘤,NSCLC在所有肺癌类型中发病率最高[15]。NSCLC确诊时多数已发生侵袭转移,这是其死亡率高的主要原因,所以研究影响NSCLC侵袭和转移的靶点显得尤为重要。miRNAs是小分子内源性非编码RNA,可以影响基因表达的转录后调控,从而起到肿瘤抑制基因或致癌基因的作用[16-17]。已有大量的证据表明,miRNAs对NSCLC的进展有影响[18-19]。在众多的miRNAs中,越来越多的研究集中在miR-375上,miR-375与癌症总体生存率显著相关,并且对多种癌症的侵袭、转移、生长和分化产生作用[8, 20]。但miR-375在NSCLC中的研究较少,它对NSCLC的影响还不甚明确,所以本研究选择了miR-375作为NSCLC的研究靶点。
本研究结果显示,miR-375在NSCLC组织中呈高表达,与相关研究结果一致[21],推测miR-375在NSCLC中起促癌基因的作用。进一步的实验结果显示,过表达miR-375后细胞的侵袭和迁移能力增强,表明miR-375可以调节NSCLC的侵袭迁移能力,并且是起促癌基因的作用。但是也有研究结果显示,miR-375在肺癌、食管癌、肝细胞癌中呈低表达[22-24]。目前miR-375在癌症中具体的作用还不确定,其是否能作为癌症治疗的靶点还有待进一步证实。目前,综合本实验结果和相关文献可以看出,miR-375既可以为癌基因,也可以为抑癌基因,它在不同肿瘤中的作用不同。MYC癌蛋白为“超级转录因子”,可以调控基因组15%左右的转录,其下游效应子可以参与核糖体生物合成、蛋白质翻译、协调细胞增殖和分化等生物功能[25-26]。本文实验结果显示,过表达miR-375后NSCLC细胞MYC蛋白的表达水平升高,表明miR-375可以通过调节MYC的表达来影响NSCLC的侵袭和迁移。EMT是一个动态变化的过程,在该过程中稳定的上皮细胞转化为不稳定的、具有转移和侵袭能力的间质细胞,故EMT在肿瘤的发生发展中扮演着不可或缺的角色[27-28]。MYC也可以通过调节EMT的发生发展来影响肿瘤进展[29]。本实验结果表明,随着miR-375的过表达,NSCLC细胞的MYC表达显著增加,侵袭和迁移能力显著增强,EMT相关蛋白的表达也发生明显变化,提示miR-375可以通过MYC/EMT影响NSCLC细胞的侵袭和迁移能力。
| [1] |
SIEGEL R L, MILLER K D, JEMAL A. Cancer statistics, 2017[J]. CA-A Cancer Journal for Clinicians, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [2] |
FELIP E, GARRIDO P, TRIGO J M, et al. SEOM guidelines for the management of non-small-cell lung cancer (NSCLC)[J]. Clinical & Translational Oncology, 2009, 11(5): 284-289. |
| [3] |
OU S H, ZELL J A, ZIOGAS A A, et al. Prognostic factors for survival of stage I nonsmall cell lung cancer patients: a po-pulation-based analysis of 19, 702 stage Ⅰ patients in the California cancer registry from 1989 to 2003[J]. Cancer, 2007, 110(7): 1532-1541. DOI:10.1002/cncr.22938 |
| [4] |
HEIST R S, ENGELMAN J A. SnapShot:non-small cell lung cancer[J]. Cancer Cell, 2012, 21(3): 448 e2. |
| [5] |
MOHAMMAD A I, SHWETA A, GOPINATH P, et al. MicroRNA in lung cancer:role, mechanisms, pathways and the-rapeutic relevance[J]. Molecular Aspects of Medicine, 2018. DOI:10.1016/j.mam.2018.07.003 |
| [6] |
WANG Jin, CHEN Jinyun, SEN S. MicroRNA as biomarkers and diagnostics[J]. Journal of Cellular Physiology, 2016, 231(1): 25-30. |
| [7] |
ARVIDSSON Y, REHAMMAR A, BERGSTROM A A, et al. miRNA profiling of small intestinal neuroendocrine tumors defines novel molecular subtypes and identifies miR-375 as a biomarker of patient survival[J]. Modern Pathology, 2018, 31(8): 1302-1317. DOI:10.1038/s41379-018-0010-1 |
| [8] |
SHAO Yingjie, GENG Yiting, GU Wendong, et al. Prognostic significance of microRNA-375 downregulation in solid tumors:a meta-analysis[J]. Disease Markers, 2014, 2014: 626185. |
| [9] |
JUNG H M, PATEL R S, PHILLIPS B L, et al. Tumor suppressor miR-375 regulates MYC expression via repression of CIP2A coding sequence through multiple miRNA-mRNA interactions[J]. Molecular Biology of the Cell, 2013, 24(11): 1638-1648, S1-7. DOI:10.1091/mbc.e12-12-0891 |
| [10] |
CONACCI-SORRELL M, MCFERRIN L, EISENMAN R N. An overview of MYC and its interactome[J]. Cold Spring Harbor Perspectives in Medicine, 2014, 4(1): a014357. DOI:10.1101/cshperspect.a014357 |
| [11] |
HE Lin, THOMSON J M, HEMANN M T, et al. A micro-RNA polycistron as a potential human oncogene[J]. Nature, 2005, 435(743): 828-833. |
| [12] |
CHEN Yali, HAN Ling, BAI Liping, et al. Trichosanthin inhibits the proliferation of cervical cancer cells and downregulates STAT-5/C-myc signaling pathway[J]. Pathology Research and Practice, 2019, 215(4): 632-638. DOI:10.1016/j.prp.2018.12.010 |
| [13] |
SU B J, XU T, BRUCE J P, et al. hsa-miR-24 suppresses metastasis in nasopharyngeal carcinoma by regulating the c-Myc/epithelial-mesenchymal transition axis[J]. Oncology Reports, 2018, 40(5): 2536-2546. |
| [14] |
CHEN K C, HSU W H, HO J Y, et al. Flavonoids luteolin and quercetin inhibit RPS19 and contributes to metastasis of cancer cells through c-Myc reduction[J]. Journal of Food and Drug Analysis, 2018, 26(3): 1180-1191. DOI:10.1016/j.jfda.2018.01.012 |
| [15] |
FADEJEVA I, OLSCHEWSKI H, HRZENJAK A. Micro-RNAs as regulators of cisplatin-resistance in non-small cell lung carcinomas[J]. Oncotarget, 2017, 8(70): 115754-115773. |
| [16] |
CHEN C Z. MicroRNAs as oncogenes and tumor suppressors[J]. The New England Journal of Medicine, 2005, 353(17): 1768-1771. DOI:10.1056/NEJMp058190 |
| [17] |
CEPPI P, MUDDULURU G, KUMARSWAMY R, et al. Loss of miR-200c expression induces an aggressive, invasive, and chemoresistant phenotype in non-small cell lung cancer[J]. Molecular Cancer Research:MCR, 2010, 8(9): 1207-1216. DOI:10.1158/1541-7786.MCR-10-0052 |
| [18] |
MORETTI F, D'ANTONA P, FINARDI E, et al. Systema-tic review and critique of circulating miRNAs as biomarkers of stage Ⅰ-Ⅱ non-small cell lung cancer[J]. Oncotarget, 2017, 8(55): 94980-94996. |
| [19] |
ZHOU Qun, HUANG Shaoxin, ZHANG Feng, et al. MicroRNAs:a novel potential biomarker for diagnosis and therapy in patients with non-small cell lung cancer[J]. Cell Prolife-ration, 2017, 50(6): e12394. DOI:10.1111/cpr.12394 |
| [20] |
LIU X H, WANG J, DONG Y H. The inhibitory effect of miR-375 targeting sp1 in colorectal cancer cell proliferation[J]. European Review for Medical and Pharmacological Sciences, 2018, 22(2): 405-411. |
| [21] |
GAN Tingqing, CHEN Wenjie, QIN Hui, et al. Clinical value and prospective pathway signaling of microRNA-375 in lung adenocarcinoma:a study based on the cancer genome atlas (TCGA), gene expression omnibus (GEO) and bioinformatics analysis[J]. Medical Science Monitor, 2017, 23: 2453-2464. DOI:10.12659/MSM.901460 |
| [22] |
CHEN Wenjie, GAN Tingqing, QIN Hui, et al. Implication of downregulation and prospective pathway signaling of microRNA-375 in lung squamous cell carcinoma[J]. Pathology Research and Practice, 2017, 213(4): 364-372. DOI:10.1016/j.prp.2017.01.007 |
| [23] |
HE X X, CHANG Y, MENG F Y, et al. MicroRNA-375 targets AEG-1 in hepatocellular carcinoma and suppresses liver cancer cell growth in vitro and in vivo[J]. Oncogene, 2012, 31(28): 3357-3369. DOI:10.1038/onc.2011.500 |
| [24] |
DING Ling, XU Yanjun, ZHANG Wei, et al. MiR-375 frequently downregulated in gastric cancer inhibits cell proliferation by targeting JAK2[J]. Cell Research, 2010, 20(7): 784-793. DOI:10.1038/cr.2010.79 |
| [25] |
MEYER N, PENN L Z. Reflecting on 25 years with MYC[J]. Nature Reviews Cancer, 2008, 8(12): 976-990. DOI:10.1038/nrc2231 |
| [26] |
DANG C V, O'DONNELL K A, ZELLER K I, et al. The c-Myc target gene network[J]. Seminars in Cancer Biology, 2006, 16(4): 253-264. DOI:10.1016/j.semcancer.2006.07.014 |
| [27] |
PUISIEUX A, BRABLETZ T, CARAMEL J. Oncogenic roles of EMT-inducing transcription factors[J]. Nature Cell Biology, 2014, 16(6): 488-494. DOI:10.1038/ncb2976 |
| [28] |
NIETO M A, HUANG R Y, JACKSON R A, et al. EMT:2016[J]. Cell, 2016, 166(1): 21-45. DOI:10.1016/j.cell.2016.06.028 |
| [29] |
LI Huaifeng, JIN Yunpeng, HU Yunping, et al. The PLGF/c-MYC/miR-19a axis promotes metastasis and stemness in gallbladder cancer[J]. Cancer Science, 2018, 109(5): 1532-1544. DOI:10.1111/cas.13585 |
 2019, Vol. 55
2019, Vol. 55

