2. 河南大学淮河医院检验科, 河南 开封 475001
骨肉瘤是一种好发于青壮年和青少年的恶性骨肿瘤[1],其恶性表型如增殖、凋亡、侵袭等与细胞内异常表达基因有关[2]。上调基因11(URG11)是近年来发现的参与细胞运动、增殖等过程的基因[3],且在胃癌、肝癌等中发挥癌基因作用,下调URG11肿瘤生长和转移能力减弱[4-5]。URG11在骨肉瘤组织中呈阳性表达,且与肿瘤病人分期、转移相关,但其在骨肉瘤细胞中的作用尚不明确[6]。本实验通过干扰URG11的表达,探讨URG11对骨肉瘤细胞恶性表型的影响,为靶向URG11治疗骨肉瘤提供依据。
1 材料与方法 1.1 细胞和试剂骨肉瘤细胞MG63购自上海研谨生物科技有限公司;polybrene购自美国Sigma公司;SYBR定量PCR试剂盒购自天根生化科技(北京)有限公司;阴性对照慢病毒和URG11短发夹RNA(shRNA)重组慢病毒由吉满生物科技(上海)有限公司构建;基质金属蛋白酶2(MMP-2)抗体、URG11抗体购自美国Abcam;裂解的半胱氨酸蛋白酶-3(Cleaved Caspase-3)抗体、基质金属蛋白酶9(MMP-9)抗体、E-钙黏蛋白(E-cadherin)抗体、裂解的半胱氨酸蛋白酶-9(Cleaved Caspase-9)抗体、波形蛋白(Vimentin)抗体购自美国Santa Cruz Biotechnology。
1.2 慢病毒感染骨肉瘤细胞以每孔5×104个接种6孔板,于培养箱内培养,细胞融合度为40%时,以MOI=20分别添加慢病毒,再加入适量的polybrene(终浓度为5 mg/L);培养12 h以后,加入新鲜培养液;培养72 h后荧光显微镜下观察荧光表达情况,以1 mg/L的嘌呤霉素筛选稳定转染的细胞系。把不感染慢病毒的细胞设置为Control组(A组),把感染阴性对照慢病毒以及URG11 shRNA重组慢病毒的细胞分别设置为shRNA-NC(B组)、URG11 shRNA(C组)。
1.3 实时荧光定量PCR(qRT-PCR)测定干扰效果A、B、C组细胞提取总RNA,反转录成cDNA后进行qRT-PCR。所用引物种类及其序列见表 1。用SYBR定量PCR试剂盒分析URG11表达变化,计算方法为2-△△CT法,内参为β-actin。每组实验重复3次,每次设3个复孔。
| 表 1 所用引物种类及其序列 |
|
|
A、B、C组细胞分别用PBS洗涤2次,再加入含有PMSF的RIPA裂解溶液,于冰上孵育30 min。以BCA法测定蛋白样品浓度,每孔30 μg蛋白样品,设置120 V的电压电泳2 h后,从玻璃板中间取出凝胶。将PVDF膜置于甲醇中孵育10 s以后进行转膜,转膜置于4 ℃条件进行。将PVDF膜置于新配置的含体积分数0.05牛血清蛋白溶液中,在室温结合2 h。把URG11一抗按1:800倍稀释,PVDF膜置于一抗反应液中孵育过夜。再将二抗按1:2 000倍稀释后,把PVDF膜置于二抗反应液内孵育2 h。使用ECL发光。采用Image J分析内参β-actin和目的条带URG11的灰度值,URG11蛋白水平=URG11的灰度值/β-actin的灰度值。每组实验重复3次,每次设3个复孔。
1.5 四甲基偶氮唑盐比色法(MTT)检测细胞增殖A、B、C组细胞培养24 h,添加20 μL的MTT溶液和180 μL细胞培养液至每个孔内培养4 h,再加入150 μL的二甲基亚砜,混合反应后,经空白孔调零。以酶标仪检测570 nm波长处的吸光度(A)值,把Control细胞的存活率设置为100%,分析其他各组细胞存活率变化。每组实验重复3次,每次设3个复孔。
1.6 流式细胞术检测细胞凋亡A、B、C组细胞中分别添加500 μL的Binding Buffer,混合后再添加PI和Annexin V-FITC染液孵育15 min,置于流式细胞仪中检测细胞凋亡变化。每组实验重复3次,每次设3个复孔。
1.7 Transwell小室检测细胞侵袭和迁移A、B、C组细胞以不含血清的培养液悬浮,细胞密度调整为7×107/L,分别添加到Transwell小室的上室内进行迁移实验。每组添加200 μL细胞悬液,下室内添加500 μL的含血清培养液。24 h后,将小室取出,把没有穿膜的细胞擦掉并以PBS洗涤后,分别添加多聚甲醛溶液固定30 min,添加甲紫染色后,在光镜下选取5个视野,计数细胞迁移数目。在侵袭实验前以基质胶将Transwell小室湿化,其余步骤同迁移实验。每组实验重复3次,每次设3个复孔。
1.8 Western blot检测细胞中相关蛋白表达变化A、B、C组细胞按照1.4中Western blot方法检测Cleaved Caspase-3、MMP-9、Cleaved Caspase-9、E-cadherin、MMP-2和Vimentin蛋白表达变化。每组实验重复3次,每次设3个复孔。
1.9 统计分析采用SPSS 21.0软件分析实验数据,计量资料数据用 x±s表示,多组差异比较用单因素方差分析,组间比较用SNK-q检验,以P < 0.05为差异有统计学意义。
2 结果 2.1 URG11 shRNA下调对骨肉瘤细胞中URG11表达水平影响URG11 shRNA慢病毒感染后骨肉瘤细胞中URG11 mRNA和蛋白表达水平明显下降,差异有显著性(F=181.200、97.307,P < 0.001)。URG11 shRNA可下调骨肉瘤细胞中URG11表达和转录。见图 1和表 2。
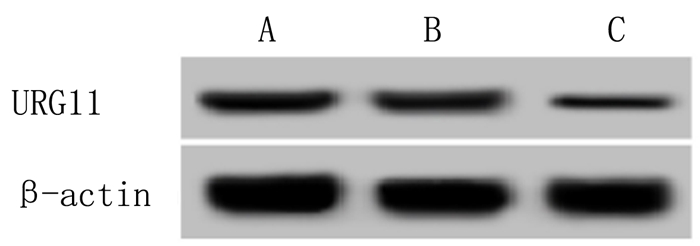 |
| A:Control组,B:shRNA-NC组,C:URG11 shRNA组。 图 1 Western blot检测URG11 shRNA对骨肉瘤细胞中URG11表达影响 |
| 表 2 URG11 shRNA对骨肉瘤细胞中URG11表达和转录影响(n=9, x±s) |
|
|
URG11 shRNA慢病毒感染后骨肉瘤细胞存活率降低、凋亡率升高,差异有显著意义(F=28.897、625.516,P < 0.05)。下调URG11可抑制骨肉瘤细胞增殖并诱导细胞凋亡。见图 2和表 3。
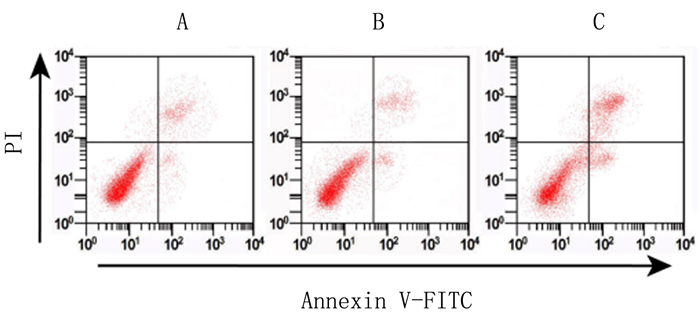 |
| A:Control组,B:shRNA-NC组,C:URG11 shRNA组。 图 2 流式细胞术检测URG11 shRNA对骨肉瘤细胞凋亡影响 |
| 表 3 URG11 shRNA对骨肉瘤细胞存活率和凋亡率影响(n=9, χ/%, x±s) |
|
|
URG11 shRNA慢病毒感染后骨肉瘤细胞侵袭和迁移数目降低,差异有统计学意义(F=93.373、101.207,P < 0.001)。下调URG11可抑制骨肉瘤细胞侵袭和迁移。见表 4。
| 表 4 URG11 shRNA对骨肉瘤细胞侵袭和迁移影响(n=9, x±s) |
|
|
URG11 shRNA慢病毒感染后,骨肉瘤细胞中凋亡蛋白Cleaved Caspase-3、Cleaved Caspase-9表达水平升高,侵袭和迁移蛋白MMP-2、MMP-9表达水平降低,间质细胞标志物Vimentin蛋白表达水平下降,上皮细胞标志物E-cadherin蛋白表达水平升高,差异均具有统计学意义(F=28.064~148.737,P < 0.01)。下调URG11则能够抑制骨肉瘤细胞中MMP-2、MMP-9蛋白表达,促进Cleaved Caspase-3、Cleaved Caspase-9蛋白表达,并且对细胞上皮间质转化(EMT)具有抑制作用。见图 3和表 5。
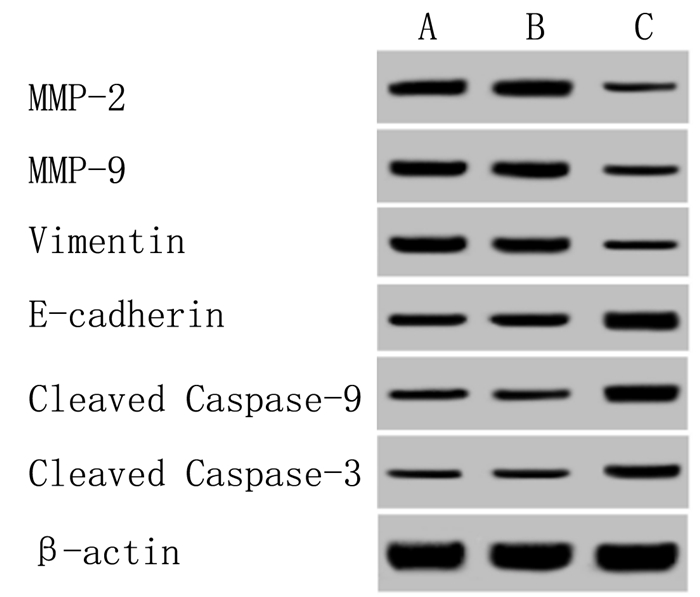 |
| A:Control组,B:shRNA-NC组,C:URG11 shRNA组。 图 3 Western blot检测URG11 shRNA对骨肉瘤细胞中相关蛋白表达影响 |
| 表 5 URG11 shRNA对骨肉瘤细胞中相关蛋白表达影响(n=9, x±s) |
|
|
URG11是被HBx蛋白上调的基因,与肿瘤的发生、发展和转移密切相关[7-8]。有报道显示,在胃癌、前列腺癌、胰腺癌、肝癌等肿瘤中URG11高表达,下调URG11表达后肿瘤细胞生长、侵袭能力减弱,说明URG11可能在肿瘤中充当癌基因[4, 9-11]。研究显示,URG11高表达于骨肉瘤组织,且与骨肉瘤病人存活时间、转移等有关[6]。本文结果表明,下调URG11后的骨肉瘤细胞的增殖能力和侵袭迁移能力降低,细胞凋亡率升高,说明下调URG11可以抑制骨肉瘤细胞的恶性表型,其作用与之前在其他肿瘤中研究报道一致。
细胞凋亡受多种因素共同调控,其中Caspase蛋白家族是目前研究较为透彻的凋亡蛋白[12]。位于Caspase凋亡反应上游的蛋白成员如Caspase-9激活后可以促进凋亡反应的发生,而位于凋亡反应下游的Caspase-3激活后诱导细胞凋亡[13-14]。而且二者只有被激活后形成Cleaved Caspase-3、Cleaved Caspase-9才可发挥促细胞凋亡功能[15-16]。文献报道,虫草素可通过上调Cleaved Caspase-3、Cleaved Caspase-9蛋白的表达诱导细胞凋亡,从而发挥抗骨肉瘤的作用[17];雷公藤红素也提高了骨肉瘤细胞HOS中Cleaved Caspase-3、Cleaved Caspase-9的表达而使细胞凋亡[18]。本文结果显示,下调URG11表达后的骨肉瘤细胞中Cleaved Caspase-3、Cleaved Caspase-9蛋白表达水平升高,这说明下调URG11可能激活Caspase凋亡反应,这与细胞凋亡检测结果一致,进一步证实了下调URG11具有诱导骨肉瘤细胞凋亡的作用。
骨肉瘤具有较高的侵袭和转移性[19];而EMT与侵袭和迁移相关,且EMT的肿瘤细胞转移能力更强[20]。E-cadherin和Vimentin是细胞EMT的标志[21-23]。骨肉瘤组织中E-cadherin呈低表达,而Vimentin高表达[24]。研究也显示,沉默Vimentin能够抑制肝癌细胞的迁移和侵袭[25]。本实验结果显示,下调URG11后的骨肉瘤细胞中E-cadherin水平升高,Vimentin水平降低,说明下调URG11可以抑制骨肉瘤细胞EMT。
此外,基质金属蛋白酶也与细胞转移相关,其可通过降解细胞外基质促进细胞转移[26]。MMP-9和MMP-2是基质金属蛋白酶的成员[27-28]。FOXF1-AS1通过MMP-2/-9途径促进骨肉瘤细胞的迁移和侵袭[29];下调MMP-9表达可抑制人骨肉瘤细胞转移[30]。本文的实验结果显示,下调URG11后的骨肉瘤细胞中MMP-2和MMP-9表达水平均下降,说明下调URG11可以抑制骨肉瘤细胞迁移和侵袭,URG11具有抗骨肉瘤细胞转移潜能。
总之,本文结果证实了下调URG11具有抗骨肉瘤细胞增殖、侵袭、迁移、EMT和诱导凋亡的作用,URG11表达可能是靶向治疗骨肉瘤的潜在靶点。本文结果为研究URG11在肿瘤中的作用提供了参考。本次实验研究没有在体内和多株骨肉瘤细胞中进行验证,后续会对上述部分内容及其具体的调控网络进行探索。
| [1] |
孙光雨, 李昊, 裴艳涛. 靶向SOX4基因的慢病毒感染对骨肉瘤MG63细胞凋亡的影响[J]. 郑州大学学报(医学版), 2018, 53(6): 64-68. |
| [2] |
LIU Ke, HUANG Jun, NI Jiangdong, et al. MALAT1 promotes osteosarcoma development by regulation of HMGB1 via miR-142-3p and miR-129-5p[J]. Cell Cycle, 2017, 16(6): 578-587. DOI:10.1080/15384101.2017.1288324 |
| [3] |
SUDA T, TSUNODA T, DAIGO Y, et al. Identification of human leukocyte antigen-A24-restricted epitope peptides derived from gene products upregulated in lung and esophageal cancers as novel targets for immunotherapy[J]. Cancer Science, 2007, 98(11): 1803-1808. DOI:10.1111/j.1349-7006.2007.00603.x |
| [4] |
DU Rui, XIA Lin, SUN Shiren, et al. URG11 promotes gastric cancer growth and invasion by activation of beta-catenin signalling pathway[J]. Journal of Cellular and Molecular Medicine, 2010, 14(3): 621-635. |
| [5] |
谢华红, 刘杰. URG11在肝癌组织表达增强并促进肝癌细胞生长[J]. 细胞与分子免疫学杂志, 2015, 31(11): 1523-1527. |
| [6] |
谢伟东. 上调基因-11在骨肉瘤中的表达及其临床意义[J]. 实用中西医结合临床, 2017, 17(1): 126-128. |
| [7] |
姚杨, 苏杰, 刘凯歌, 等. 上调基因-11(URG11)生物信息学与功能分析[J]. 生物技术通报, 2016, 32(3): 203-208. |
| [8] |
TONG Guangdong, ZHANG Xi, ZHOU Daqiao, et al. Efficacy of early treatment on 52 patients with preneoplastic hepatitis B virus-associated hepatocellular carcinoma by compound Phyllanthus Urinarial[J]. Chinese Journal of Integrative Medicine, 2014, 20(4): 263-271. DOI:10.1007/s11655-013-1320-7 |
| [9] |
潘斌, 邓志海, 吴友科, 等. 沉默URG11基因对前列腺癌LNCaP细胞增殖、迁移与侵袭的影响[J]. 中国病理生理杂志, 2016, 32(4): 658-664. DOI:10.3969/j.issn.1000-4718.2016.04.013 |
| [10] |
PENG Wei, ZHANG Jun, LIU Jie. URG11 predicts poor prognosis of pancreatic cancer by enhancing epithelial-mesenchymal transition-driven invasion[J]. Medical Oncology, 2014, 31(7): 1-7. |
| [11] |
FAN Rui, LI Xiaohua, DU Wenqi, et al. Adenoviral-mediated RNA interference targeting URG11 inhibits growth of human hepatocellular carcinoma[J]. International Journal of Cancer, 2011, 128(12): 2980-2993. DOI:10.1002/ijc.25624 |
| [12] |
LÓPEZ-GARCÍA C, SANSREGRET L, DOMINGO E, et al. BCL9L Dysfunction impairs caspase-2 expression permitting aneuploidy tolerance in colorectal cancer[J]. Cancer Cell, 2017, 31(1): 79-93. DOI:10.1016/j.ccell.2016.11.001 |
| [13] |
ZHANG Rui, XU Jian, ZHAO Jian, et al. Knockdown of miR-27a sensitizes colorectal cancer stem cells to TRAIL by promoting the formation of Apaf-1-caspase-9 complex[J]. Oncotarget, 2017, 8(28): 45213-45223. |
| [14] |
PU X, STORR S J, ZHANG Y M, et al. Caspase-3 and caspase-8 expression in breast cancer: caspase-3 is associated with survival[J]. Apoptosis, 2017, 22(3): 357-368. DOI:10.1007/s10495-016-1323-5 |
| [15] |
ASSUMPÇÃO L D, GONÇALVES B V, AGUIRRE B L, et al. Immunoexpression of cleaved caspase-3 shows lower apoptotic area indices in lip carcinomas than in intraoral cancer[J]. Journal of Applied Oral Science: Revista FOB, 2016, 24(4): 359-365. DOI:10.1590/1678-775720160156 |
| [16] |
KOYUNCU I, GONEL A, KOCYIGIT A, et al. Selective inhibition of carbonic anhydrase-Ⅸ by sulphonamide derivatives induces pH and reactive oxygen species-mediated apoptosis in cervical cancer HeLa cells[J]. Journal of Enzyme Inhibition & Medicinal Chemistry, 2018, 33(1): 1137-1149. |
| [17] |
梅红军, 刘洋. 虫草素对人骨肉瘤MG-63细胞凋亡的影响及其机制研究[J]. 医学研究杂志, 2018, 47(12): 81-84. |
| [18] |
朱韬, 郑有卯. 雷公藤红素诱导人骨肉瘤细胞系HOS凋亡及机制研究[J]. 浙江中西医结合杂志, 2015, 25(8): 723-726. DOI:10.3969/j.issn.1005-4561.2015.08.006 |
| [19] |
孙大菊, 张玉成, 王雅丽. Decorin对骨肉瘤MG63细胞侵袭和转移的影响[J]. 中国实验诊断学, 2017, 21(11): 1987-1990. DOI:10.3969/j.issn.1007-4287.2017.11.038 |
| [20] |
ZHANG M, WU W B, WANG Z W, et al. lncRNA NEAT1 is closely related with progression of breast cancer via promoting proliferation and EMT[J]. European Review for Medical and Pharmacological Sciences, 2017, 21(5): 1020-1026. |
| [21] |
CHEN Feifei, LIU Xin, CHENG Qian, et al. RUNX3 regulates renal cell carcinoma metastasis via targeting miR-6780a-5p/E-cadherin/EMT signaling axis[J]. Oncotarget, 2017, 8(60): 101042-101056. |
| [22] |
SATELLI A, BATTH I, BROWNLEE Z, et al. EMT circulating tumor cells detected by cell-surface vimentin are asso-ciated with prostate cancer progression[J]. Oncotarget, 2017, 8(30): 49329-49337. |
| [23] |
SHAN Tao, CHEN Shuo, CHEN Xi, et al. Prometastatic mechanisms of CAF-mediated EMT regulation in pancreatic cancer cells[J]. International Journal of Oncology, 2017, 50(1): 121-128. |
| [24] |
冯晓雷, 吴俊毅. 骨肉瘤组织中E-钙黏蛋白波形蛋白和纤维连接蛋白的表达及临床意义[J]. 中国肿瘤, 2015, 22(11): 1315-1317. |
| [25] |
柳严, 张德林, 王国良, 等. shRNA介导的波形蛋白基因沉默对肝癌细胞迁移、侵袭能力的影响[J]. 郑州大学学报(医学版), 2018, 53(6): 48-52. |
| [26] |
张先燎, 施鑫. 基质金属蛋白酶及金属蛋白酶组织抑制剂与骨肉瘤侵袭转移的关系[J]. 医学研究生学报, 2009, 22(9): 996-1000. DOI:10.3969/j.issn.1008-8199.2009.09.027 |
| [27] |
RAO Q, CHEN Y, YEH C R, et al. Recruited mast cells in the tumor microenvironment enhance bladder cancer metastasis via modulation of ER beta/CCL2/CCR2 EMT/MMP9 signals[J]. Oncotarget, 2016, 7(7): 7842-7855. |
| [28] |
LIU Yusi, SUN Xiaojiao, FENG Jinfa, et al. MT2-MMP induces proteolysis and leads to EMT in carcinomas[J]. Oncotarget, 2016, 7(30): 48193-48205. |
| [29] |
ZHU Kunpeng, ZHANG Chunlin, MA Xiaolong. Antisense lncRNA FOXF1-AS1 promotes migration and invasion of osteosarcoma cells through the FOXF1/MMP-2/-9 pathway[J]. International Journal of Biological Sciences, 2017, 13(9): 1180-1191. DOI:10.7150/ijbs.21722 |
| [30] |
CHANG P Y, HSIEH M J, HSIEH Y S, et al. Tricetin inhi-bits human osteosarcoma cells metastasis by transcriptionally repressing MMP-9 via p38 and Akt pathways[J]. Environmental Toxicology, 2017, 32(8): 2032-2040. DOI:10.1002/tox.22380 |
 2019, Vol. 55
2019, Vol. 55

