视网膜母细胞瘤是一种较为常见的恶性肿瘤, 常发生于5岁以下婴幼儿, 具有一定的家族倾向, 且容易发生颅内和远处转移, 严重威胁病儿的生命健康[1-4]。目前, 视网膜母细胞瘤发病机制仍不完全清楚, 一般认为与基因突变、表观遗传修饰等多种分子机制有关[6-7]。研究表明, 细胞癌变与细胞周期调控异常密切相关, 细胞周期调节蛋白(Cyclin D1)及视网膜母细胞瘤蛋白(pRb)等均参与了细胞周期G1/S期的转换, 与肿瘤的发生发展密切相关[8-9], 但目前对于Cyclin D1和pRb与视网膜母细胞瘤发病相关性及作用机制的研究较少。本研究对视网膜母细胞瘤病人癌组织及其配对的癌旁正常组织的Cyclin D和pRb表达水平进行检测, 并分析两种蛋白表达与病人临床病理特征及预后的关系, 旨在为视网膜母细胞瘤诊治和预后判断提供依据。
1 资料与方法 1.1 一般资料2010年9月—2015年1月, 选取我院眼科收治、经病理诊断为视网膜母细胞瘤并行手术摘除眼球病人62例(70眼), 男23例(26眼), 女39例(44眼); 病人年龄4个月~9.5岁, 平均(4.1±0.8)岁; 分化型25眼, 未分化型45眼; 发生神经浸润36眼, 未发生神经浸润34眼; 出现淋巴结转移30眼, 无淋巴结转移40眼。所有病儿术前均未接受化疗及局部放疗等治疗。收集70眼手术摘除眼球标本癌组织和癌旁组织(距癌灶边缘5 cm)。本研究获得所有病儿监护人知情同意及医院的伦理学审核。
1.2 Western blot方法检测Cyclin D1及pRb水平取癌组织及其配对的癌旁正常组织制备蛋白样本, 以100 g/L十二烷基硫酸钠(SDS)聚丙烯酰胺凝胶进行电泳, 分离后转移至孔径为0.45 μm的聚偏二氟乙烯(PVDF)膜, 置于50 g/L脱脂奶粉中封闭2 h; 加入一抗Cyclin D1兔抗人单克隆抗体和pRb兔抗人单克隆抗体(美国abcam公司), 4 ℃孵育过夜; 以5 g/L TBS-T溶液洗膜3次后加入HRP标记的二抗进行反应; 以5 g/L TBS-T溶液洗膜3次, 用化学发光法进行显色, 并采用Quantity One软件(BIO-RAD公司)进行灰度值分析, 计算各目标蛋白与β-actin的灰度比值。
1.3 免疫组化方法检测Cyclin D1及pRb表达取癌组织及其配对的癌旁正常组织常规石蜡包埋, 厚度4 μm连续切片, 常规脱蜡至水, 切片浸入50 mmol/L(pH值8.0)乙二胺四乙酸溶液中, 后用微波抗原修复10 min; 冷却到室温, 充分水洗以及磷酸盐缓冲液(PBS)浸洗, 并滴加正常山羊血清封闭液, 室温维持20 min; 去掉多余液体, 加入Cyclin D1和pRb多抗或单抗, 维持4 ℃过夜后PBS洗涤; 再加入SP 9000通用型生物素标记的二抗, 37 ℃维持40 min; 用二氨基联苯胺(DAB)显色30 s, 苏木精复染, 系列乙醇脱水及透明, 中性树胶封固, 显微镜下观察。每张切片选择5个具有代表性的高倍视野, 以细胞胞质或细胞核中出现棕黄色颗粒为阳性细胞, 阳性细胞占计数细胞百分率> 10%为阳性表达[10-12]。
1.4 病理特征诊断① 分化型特点为:瘤细胞呈方形或低柱状排列, 细胞核偏心、相对较小, 胞质较多, 核分裂象少, 以蔷薇花或菊形团和小花结构为主, 围绕一个中央腔隙形成菊花形; 未分化型特点为:瘤细胞排列不规则, 细胞形态、大小不均, 胞浆少, 核大深染, 核分裂象较多, 绕血管外围的存活瘤细胞可呈珊瑚样或指套样排列(图 1A、B)。②通过眼眶MRI、颅脑MRI检查病儿是否出现视神经浸润和淋巴结转移。视神经转移表现为视神经增粗, T2WI呈较高信号, T1WI呈较低信号, 增强后明显强化(图 1C); 颈部淋巴结转移图像特点见图 1D。
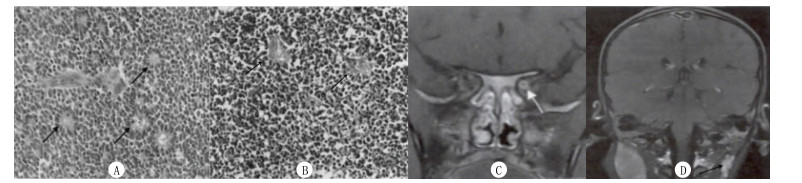 |
| A、B为视网膜母细胞瘤组织不同分型病理特点(免疫组化染色, 40倍):A分化型; B未分化型。C:视网膜母细胞瘤病儿视神经转移MRI表现, 增强后冠状面T1WI图像肿瘤沿视神经向后蔓延(白色箭头)。D:视网膜母细胞瘤病儿颈部淋巴结转移MRI图像, 增强后冠状面T1WI左侧颈部多发淋巴结增大(黑箭头)。 图 1 视网膜母细胞瘤的病理组织学和影像学检查 |
对视网膜母细胞瘤组织中Cyclin D1及pRb表达水平进行统计分析, 以高于正常组织Cyclin D1水平为Cyclin D1阳性, 低于正常组织pRb水平为pRb阴性, 分析Cyclin D1、pRb蛋白水平与生存时间的相关性。术后定期电话随访, 截至2017年6月, 统计自手术日至末次随访的时间, 生存时间以月为单位, 研究结束、其他原因死亡和失访作为截尾数据处理[13]。
1.6 统计学方法使用SPSS 16.0和GraphPad Prism 5软件进行统计学分析。两组计量资料结果以x±s形式表示, 组间比较采用t检验, P < 0.05表示差异有统计学意义[14]。应用Kaplan-Meier法对视网膜母细胞瘤病人累积生存曲线进行log-rank检验。
2 结果 2.1 Cyclin D1、pRb表达及其与病人临床病理特征的相关性视网膜母细胞瘤肿瘤组织中Cyclin D1表达水平显著高于癌旁组织(t=-15.79, P < 0.01), pRb表达水平显著低于癌旁组织(t=183.51, P < 0.01);肿瘤组织分化型Cyclin D1、pRb表达水平均高于未分化型(t=55.30、43.91, P < 0.01);伴神经浸润和淋巴结转移的肿瘤组织中Cyclin D1表达高于未出现神经浸润和淋巴结转移者(t=71.03、49.44, P < 0.01), pRb表达低于未出现神经浸润和淋巴结转移者(t=-151.80、-69.97, P < 0.01)。见图 2、表 1。
 |
| 图 2 视网膜母细胞瘤癌组织Cyclin D1及pRb表达Western blot检测 |
| 表 1 不同病理学特征分组视网膜母细胞瘤Cyclin D1和pRb表达比较(x±s) |
|
|
视网膜母细胞瘤70眼中, Cyclin D1表达阳性55眼、阴性15眼, pRb表达阳性10眼、阴性60眼。log-rank分析结果显示, Cyclin D1表达阳性的病儿累计生存率显著低于阴性病儿, pRb表达阳性病儿累计生存率显著高于阴性病儿, 差异有统计学意义(P < 0.01)。见图 3~5。
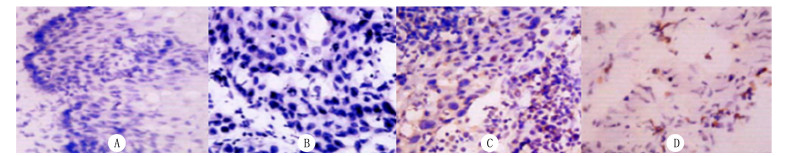 |
| A、B为癌旁组织; C、D为肿瘤组织。A、C为Cyclin D1蛋白; B、D为pRb蛋白。 图 3 Cyclin D1蛋白和pRb蛋白表达免疫组化染色 |
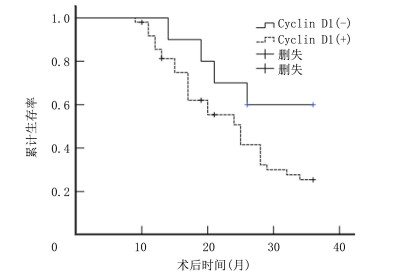 |
| 图 4 Cyclin D1表达与视网膜母细胞瘤预后关系的生存函数图 |
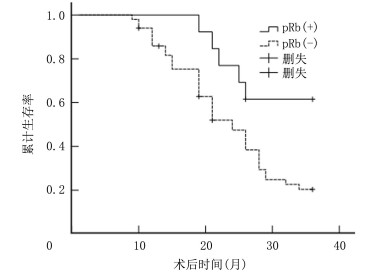 |
| 图 5 pRb表达与视网膜母细胞瘤预后关系的生存函数图 |
视网膜母细胞瘤是婴幼儿眼病中性质最严重、危害性最大的一种恶性肿瘤, 主要来源于光感受器前体细胞, 常见于3岁以下儿童[15-17]。视网膜母细胞瘤具有一定的家族遗传倾向, 可单眼、双眼先后或同时罹患, 且易发生颅内及远处转移, 常常危及病儿生命[18]。视网膜母细胞瘤病人的临床表现多为结膜内充血和水肿、角膜水肿、虹膜新生血管、玻璃体浑浊、眼压升高及斜视等, 但其确切的病因和具体发病机制目前尚不完全清楚[19-20]。研究表明, 视网膜母细胞瘤可能与遗传和病毒感染等因素有关, 而原癌基因的激活、抑癌基因的失活以及转录调控可能是肿瘤发生和发展的分子机制[21]。
Cyclin D1是一种反映细胞周期变化的蛋白, 也是细胞周期的正向调控因子, 主要负责细胞周期进展中的G1/S转换, 一旦Cyclin D1表达异常上调, 则会导致组织细胞生长无序增加, 进而导致肿瘤的发生[22]。近年来, Cyclin D1在肿瘤发生发展中的作用越来越受到重视, 在很多恶性肿瘤中均发现了Cyclin D1过度表达[23-24]。有研究表明, Cyclin D1过表达与宫颈癌的发生发展以及组织学类型、分化程度等密切相关[25]; 还有研究认为, Cyclin D1高表达在肝癌的疾病过程也发挥着重要的作用[26]。本研究表明, Cyclin D1在视网膜母细胞瘤组织中的表达水平显著高于癌旁组织, 分化型肿瘤组织Cyclin D1表达高于未分化型, 伴随神经浸润和淋巴结转移的肿瘤组织中Cyclin D1表达高于未出现神经浸润和淋巴结转移者, 提示Cyclin D1表达在视网膜母细胞瘤的发生、发展过程中起着重要的作用, Cyclin D1相对表达量越高, 肿瘤的分化程度越高。
pRb是一种肿瘤抑制蛋白, 也是细胞周期调控蛋白, 其基因Rb位于人类染色体13q14上, 可以通过抑制细胞周期进程, 防止细胞过度生长直至其具备分裂条件, 与肿瘤细胞的增殖有密切的关系[27]。研究表明, pRb在乳癌、鼻咽癌、结直肠癌等多种肿瘤组织中表达异常, 而其缺失和突变均可能会影响细胞增殖调控[28]。本研究结果显示, pRb在肿瘤组织中的表达水平显著低于癌旁组织, 分化型肿瘤组织pRb表达低于未分化型, 伴随神经浸润和淋巴结转移的肿瘤组织中pRb表达低于未出现神经浸润和淋巴结转移者, 提示pRb在视网膜母细胞瘤的病理进程中起着重要的作用, 其相对表达量越低, 肿瘤的分化程度越低。
本文结果还显示, Cyclin D1表达阳性的病人累计生存率显著低于阴性病人, pRb表达阳性病人累计生存率显著低于阴性病人, Cyclin D1和pRb的表达与视网膜母细胞瘤病人预后明显相关, Cyclin D1相对表达量越高, pRb相对表达量越低, 病人的预后越差, 生存期越短。Cyclin D1和pRb表达检测可能成为视网膜母细胞瘤预后的监测指标。
综上所述, Cyclin D1、pRb在视网膜母细胞瘤的发生、发展过程中发挥重要作用, Cyclin D1、pRb有可能成为视网膜母细胞瘤预后的监测指标。
| [1] |
ABRAMSON D H, ELLSWORTH R M, ZIMMERMAN L E. Nonocular cancer in retinoblastoma survivors[J]. Transactions. Section on Ophthalmology. American Academy of Ophthalmology and Otolaryngology, 2015, 81(3 Pt 1): 454-457. |
| [2] |
HANAHAN D, WEINBERG R A. Hallmarks of cancer: the next Generation[J]. Cell, 2011, 144(5): 646-674. DOI:10.1016/j.cell.2011.02.013 |
| [3] |
陆烨, 童剑萍. 视网膜母细胞瘤的发生机制及诊断和治疗进展[J]. 现代肿瘤医学, 2016, 24(6): 1007-1014. |
| [4] |
刘朝, 唐耀冰, 杨延芳. miR-130b通过调控PTEN在人视网膜母细胞瘤发挥促癌作用[J]. 眼科, 2017, 26(4): 276-281. |
| [5] |
曾汉荣, 杨虹女, 李文星, 等. 喉鳞状细胞癌患者视网膜母细胞瘤蛋白和细胞周期调节蛋白D1异常表达[J]. 微循环学杂志, 2016, 26(2): 66-69. |
| [6] |
张阳. 视网膜母细胞瘤蛋白、基质金属蛋白酶3和人细胞周期素D2在上皮性卵巢癌中的表达及临床意义[J]. 中国现代医学杂志, 2015, 25(11): 46-50. |
| [7] |
刘娟, 殷飞, 姚树坤. 细胞周期素D1、视网膜母细胞瘤样蛋白2及微小染色体维持蛋白7在肝细胞癌中的表达及对预后的意义[J]. 中国病理生理杂志, 2011, 27(2): 304-309. |
| [8] |
CHO W C. MicroRNAs: potential biomarkers for cancer diagnosis, prognosis and targets for therapy[J]. The International Journal of Biochemistry & Cell Biology, 2010, 42(8): 1273-1281. |
| [9] |
RODRIGUEZ G C, ORBACH D B, VANDERVEEN D. Retinoblastoma[J]. Pediatric Clinics of North America, 2015, 62(1): 201-223. DOI:10.1016/j.pcl.2014.09.014 |
| [10] |
BENAVENTE C A, DYER M A. Genetics and epigenetics of human retinoblastoma[J]. Annual Review of Pathology, 2015, 10(1): 547-562. DOI:10.1146/annurev-pathol-012414-040259 |
| [11] |
胡慧敏, 张伟令, 王一卓, 等. 视网膜母细胞瘤远处转移期的临床特点和治疗及预后分析[J]. 中华眼科杂志, 2017, 53(2): 121-127. |
| [12] |
赵敬聪, 王建仓, 苏鸣, 等. 儿童视网膜母细胞瘤临床分析[J]. 河北医药, 2015, 37(8): 1183-1185. |
| [13] |
王一卓, 黄东生, 史季桐, 等. 侵犯视神经的视网膜母细胞瘤患儿465例预后分析[J]. 中华儿科杂志, 2015, 53(2): 109-113. |
| [14] |
BAH N A, ZEK R A, SA S, et al. The possible role of cell cycle regulators in mult is tep process of HPV-associated cervical carcinoma[J]. BMC Clinical Pathology, 2007, 7(5): 4. |
| [15] |
PATIL M A, LEE S A, MACIAS E, et al. Role of cyclin D1 as a mediator of c-Met- and beta-catenin-induced hepatocarcinogenesis[J]. Cancer Research, 2009, 69(1): 253-261. DOI:10.1158/0008-5472.CAN-08-2514 |
| [16] |
刘智屏, 周克英, 陈俐丽, 等. 视网膜母细胞瘤相关血清肿瘤标记物的初步研究[J]. 中国当代儿科杂志, 2017, 19(3): 318-321. |
| [17] |
伍瑛, 陈永东, 李凡, 等. 载自杀基因的靶向微泡联合超声辐照抑制视网膜母细胞瘤的实验研究[J]. 临床超声医学杂志, 2017, 19(11): 11-14. |
| [18] |
迟林, 邓红. 视网膜母细胞瘤患者细胞免疫功能状态的改变[J]. 检验医学与临床, 2017, 14(2): 172-173, 176. |
| [19] |
孟庆娱, 黄旅珍, 王斌, 等. 基因捕获技术在视网膜母细胞瘤患者RB1基因突变筛选的应用[J]. 中华眼科杂志, 2017, 53(6): 455-459. |
| [20] |
ZHAO Yuehua, ZHANG Shilian, ZHANG Yongfeng. MicroRNA-320 inhibits cell proliferation, migration and invasion in retinoblastoma by targeting specificity protein 1[J]. Molecular Medicine Reports, 2017, 16(2): 2191-2198. DOI:10.3892/mmr.2017.6767 |
| [21] |
刘智屏, 李博, 陈俐丽, 等. 视网膜母细胞瘤肿瘤标志物筛选研究[J]. 中国全科医学, 2017, 20(18): 2213-2217. |
| [22] |
闫义涛, 王晓丽, 谷圆圆, 等. 长链非编码RNA MALAT1靶向miR-570-3p对人视网膜母细胞瘤细胞系SO-Rb50增殖、凋亡和侵袭的调控作用[J]. 中国免疫学杂志, 2018, 34(11): 27-37. |
| [23] |
黄东生, 张谊. 儿童视网膜母细胞瘤[J]. 中国实用儿科杂志, 2018, 33(10): 757-763. |
| [24] |
王艳军, 王高雄, 黄天从, 等. 高迁移率族蛋白1通过调控Erk1/2, Cyclin D1及MMP14蛋白促进肝内胆管细胞癌进展[J]. 第三军医大学学报, 2019, 41(5): 38-44. |
| [25] |
HORVATH B M, KOUROVA H, NAGY S, et al. Arabidopsis retinoblastoma related directly regulates DNA damage responses through functions beyond cell cycle control[J]. EMBO Journal, 2017, 36(9): 1261-1278. DOI:10.15252/embj.201694561 |
| [26] |
张凡, 齐鹏飞, 李道明, 等. 甲状腺癌组织中GPX3和Bcl-2, CyclinD1蛋白的表达及意义[J]. 山东医药, 2018, 58(25): 63-66. |
| [27] |
WANG Lilun, FENG Yanqin, CHENG Yuhong, et al. Effect on proliferation and apoptosis of retinoblastoma cell by RNA inhibiting high mobility group protein box-1 expression[J]. International Journal of Ophthalmology, 2017, 10(1): 30-34. |
| [28] |
戴桂红, 陈民, 陈斯泰, 等. 母细胞性浆细胞样树突细胞肿瘤的病理及鉴别诊断[J]. 肿瘤研究与临床, 2017, 29(7): 482-484. |
 2019, Vol. 55
2019, Vol. 55

