肾病综合征是一种发展缓慢、相对良性的疾病,但若未能及时有效诊治可导致病情进展甚至发展成为慢性肾衰竭。氧化应激是多种病理损伤的共同途径,贯穿于慢性肾脏病发生、发展的过程中。慢性肾脏病的发生、发展及恶化与体内氧化物质增多、抗氧化物质减少密切相关[1]。KURO-O等[2]研究显示,klotho主要在肾脏中高表达。MITANI等[3]采用原位杂交技术研究表明,Klotho mRNA主要在肾小管上皮细胞中表达,氧化应激和肾素-血管紧张素系统(RAS)的激活可以抑制其在肾脏中的表达。有研究结果表明,在肾小球肾炎模型小鼠体内过表达klotho蛋白,可使小鼠具有对抗氧化应激从而减少肾损伤的功能[4]。以上研究表明,klotho蛋白在体内能够抑制氧化应激,可以通过检测klotho蛋白在体内的表达水平估测小鼠肾脏的损伤情况。奥美沙坦酯为血管紧张素Ⅱ受体拮抗剂,临床上常用于降低血压和减少尿蛋白。有研究表明,奥美沙坦酯通过抑制血管紧张素Ⅱ引起的氧化应激起到保护肾脏的作用[5]。他克莫司为新型免疫抑制剂,属于钙调神经蛋白酶抑制剂,可对钙离子传导通路进行干扰,特异性提高细胞内钙离子浓度,减弱细胞去磷酸化功能,对白细胞介素分泌进行控制,发挥免疫抑制作用,近年来开始应用于肾病综合征的临床治疗,具有减少尿蛋白、延缓肾脏疾病进展的作用。本研究采用单次尾静脉注射阿霉素方法建立阿霉素肾病模型,给予奥美沙坦酯及他克莫司灌胃治疗,探讨两种药物对模型大鼠肾脏氧化应激反应及klotho蛋白表达的影响,以期为他克莫司治疗肾病综合征提供新的理论支持。
1 材料与方法 1.1 实验材料 1.1.1 动物清洁级雄性Wistar大鼠60只,体质量230~260 g,购自北京维通利华实验动物技术有限公司,许可证号SCXK(京)2016-0006,饲养于青岛大学医学院动物房。
1.1.2 主要试剂奥美沙坦酯(第一三共制药(上海)有限公司),盐酸阿霉素(MedChemExpress),他克莫司(Astellas Ireland Co., Ltd),兔抗鼠anti-klotho多克隆抗体(英国Abcam),β-actin(北京博奥森),免疫组化试剂盒(北京中杉金桥),DAB显色试剂盒(福州迈新),苏木精-伊红染色试剂(北京索莱宝),Trizol试剂(美国Invitrogen),cDNA反转录试剂盒和RT-PCR试剂盒(北京Takara)。
1.2 实验方法 1.2.1 动物分组及处理大鼠适应性喂养1周后,随机分为正常对照组(NC组)、阿霉素肾病模型组(ADR组)、奥美沙坦酯治疗组(OLM组)以及他克莫司治疗组(FK506组),每组15只。其中ADR组、OLM组和FK506组大鼠给予一次性尾静脉注射阿霉素5 mg/kg造模,NC组大鼠注射等量的生理盐水。7 d后留取大鼠24 h尿蛋白,与正常对照大鼠相比,尿蛋白升高有统计学意义视为造模成功[6]。造模后,OLM组连续12周给予奥美沙坦酯10 mg/(kg·d)灌胃[5],FK506组连续12周给予他克莫司0.5 mg/(kg·d)灌胃[7],NC组及ADR组给予等量生理盐水灌胃。
1.2.2 24 h尿蛋白检测于实验第4、8、12周末从每组中随机各选5只大鼠放入清洁代谢笼中,收集24 h尿液,-80 ℃保存,用于检测24 h尿蛋白定量。实验重复3次,取均值。
1.2.3 标本采集分别于实验第4、8、12周末每组取5只大鼠,处死,打开腹腔游离肾脏。迅速取出一侧肾脏放入40 g/L中性甲醛中固定,4 ℃保存,用于苏木精-伊红染色和免疫组织化学染色;将另一侧肾组织快速放入液氮中,-80 ℃保存,用于Western blot和实时荧光定量PCR(q-PCR)。
1.2.4 肾组织病理学观察肾组织经包埋制成石蜡切片,切片脱蜡、复水后经苏木精染色10 min、伊红染色5 min,脱水、透明、封片,在显微镜下观察肾组织病理改变。
1.2.5 超氧化物歧化酶(SOD)和丙二醛(MDA)的测定采用羟胺法检测大鼠肾组织中SOD活性,采用比色法检测大鼠肾组织中MDA含量。均严格按照试剂盒说明进行操作。实验重复3次,取均值。
1.2.6 Western blot检测klotho蛋白的表达提取肾组织中总蛋白,加入RIPA裂解液匀浆后,用BCA法检测蛋白浓度,加入4×蛋白上样缓冲液,金属浴煮沸5 min,各组蛋白分别上样,用100 g/L SDS-PAGE分离后转移到PVDF膜上,以体积分数0.05的牛奶封闭1 h,加入一抗klotho(1:1 000)和β-actin(1:2 000),4 ℃孵育过夜,洗膜,加入二抗常温孵育,洗膜后显影,用Image J软件分析蛋白的相对表达量。实验重复3次,取均值。
1.2.7 q-PCR检测klotho mRNA的表达按照Triol试剂说明书提取肾组织总RNA,逆转录合成cDNA,进行q-PCR。引物由睿博兴科生物技术有限公司合成,引物序列见表 1。反应条件为:95 ℃、10 s,57 ℃、30 s,共40个循环。用2-△△Ct计算目的基因mRNA相对表达量。实验重复3次,取均值。
| 表 1 PCR检测所用引物序列 |
|
|
应用GraphPad Prism 5.0软件进行统计学分析,所得实验数据以x±s表示,数据间比较采用析因设计的方差分析,相关性分析采用Spearson相关分析,以P < 0.05为差异有统计学意义。
2 结果 2.1 造模后大鼠一般情况大鼠尾静脉注射阿霉素1周后均出现不同程度的腹泻,食量下降,活动减少;2周后腹泻逐渐停止,饮食及活动逐渐恢复;第3周出现轻度水肿,以足部及睾丸最明显;第4周水肿最重。
2.2 各组大鼠24 h尿蛋白定量比较大鼠24 h尿蛋白定量检测组别与时间存在交互效应(F时间×组别=101.579,P < 0.05)。ADR组、OLM组及FK506组大鼠各时间点24 h尿蛋白含量均高于NC组,OLM组和FK506组较ADR组降低,FK506组较OLM组降低,差异均有统计学意义(F=126.969~781.905,P < 0.05);组内比较,随着时间的延长,ADR组24 h时尿蛋白含量进行性升高,OLM组和FK506组进行性降低,差异具有统计学意义(F=16.957~182.942,P < 0.05)。见表 2。
| 表 2 不同时间点各组大鼠24 h尿蛋白定量比较(n=5,m/mg,x±s) |
|
|
与NC组相比,ADR组实验第4周末可见肾小管上皮细胞轻度萎缩,上皮细胞内有颗粒和空泡变性,近端小管上皮细胞刷状缘脱落、管腔扩大并可见蛋白管型及少量炎细胞浸润;第8周末可见肾小管上皮细胞明显萎缩,空泡及颗粒变性更加明显,管内蛋白管型较前增多,间质血管肿胀更加明显,炎细胞数量增多;第12周末可见肾小管灶状萎缩,蛋白管型更多,肾间质小动脉管壁增厚、管腔狭窄,间质内炎细胞浸润更加明显,并有轻度纤维化。OLM组和FK506组大鼠肾脏的病理表现较ADR组呈时间依赖性的减轻,且FK506组病理改变较OLM组更加明显。
2.4 各组大鼠肾组织SOD活性和MDA含量比较大鼠肾组织SOD活性检测组别与时间存在交互效应(F时间×组别= 201.531,P < 0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中SOD活性均较NC组降低,OLM组和FK506组较ADR组升高,FK506组较OLM组升高,差异均有显著意义(F=125.782~467.589,P < 0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中SOD活性进行性降低,OLM组及FK506组进行性升高,差异具有显著性(F=6.871~57.072,P < 0.05)。见表 3。
| 表 3 不同时间点各组大鼠肾组织SOD活性的比较(n=5,z/m(kU/g),x±s) |
|
|
大鼠肾组织MDA含量检测组别与时间存在交互效应(F时间×组别= 67.026,P < 0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中MDA含量均较NC组升高,OLM组及FK506组较ADR组降低,FK506组较OLM组降低,差异具有统计学意义(F=52.782~162.589,P < 0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中MDA含量进行性升高,OLM组及FK506组进行性降低,差异具有显著性(F=6.871~57.072,P < 0.05)。见表 4。
| 表 4 不同时间点各组大鼠肾组织MDA含量的比较(n=5,z/m(μmol/g),x±s) |
|
|
大鼠肾组织中klotho mRNA表达检测组别与时间存在交互效应(F时间×组别=326.571,P < 0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中klotho mRNA的表达均较NC组降低,OLM组及FK506组较ADR组升高,FK506组较OLM组升高,差异具有统计学意义(F=116.671~507.513,P < 0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中klotho mRNA的表达进行性降低,OLM组和FK506组的表达进行性升高,差异具有统计学意义(F=12.982~40.485,P < 0.05)。见表 5。
| 表 5 不同时间点各组大鼠肾组织中klotho mRNA相对表达量的比较(n=5,x±s) |
|
|
大鼠肾组织中klotho蛋白表达检测组别与时间存在交互效应(F时间×组别=223.581,P < 0.05)。ADR组、OLM组及FK506组大鼠各时间点肾组织中klotho蛋白的表达均较NC组降低,OLM组及FK506组较ADR组升高,FK506组较OLM组升高,差异具有统计学意义(F=126.969~609.513,P < 0.05);组内比较,随着时间的延长,ADR组大鼠肾组织中klotho蛋白表达进行性降低,OLM组和FK506组进行性升高,差异具有统计学意义(F=10.985~38.405,P < 0.05)。见图 1。
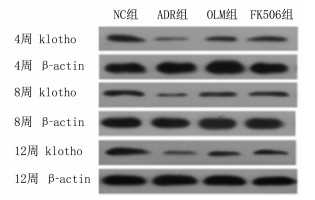 |
| 图 1 不同时间点各组大鼠肾组织中klotho蛋白表达的Western blot检测 |
大鼠肾组织中klotho蛋白表达与MDA含量及24 h尿蛋白定量呈负相关(r=-0.896、-0.948,P < 0.01),与SOD活性呈正相关(r=0.927,P < 0.01)。见图 2。
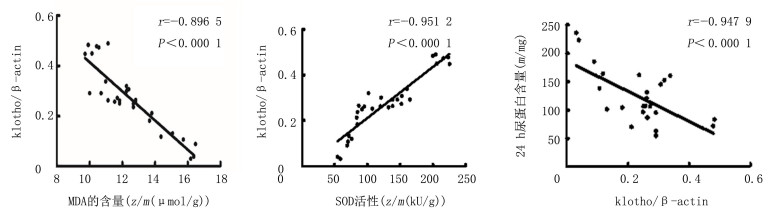 |
| 图 2 klotho蛋白表达与氧化应激的关系 |
阿霉素肾病模型是目前公认的肾病综合征动物模型。阿霉素对肾脏具有慢性毒性作用,它可以通过多种机制引起肾脏损伤,其中氧化应激是比较常见和重要的机制之一。有研究表明,活性氧(ROS)是引起足细胞损伤的重要因素[8]。另有研究表明,ROS可引起肾小管内皮细胞损伤,影响肾小管的重吸收作用,从而导致大量蛋白质随尿液排出体外,引起蛋白尿[9]。蛋白尿是诊断肾病综合征的标准之一,也是肾功能进展的独立危险因素。Klotho是一种与衰老相关的基因,其对机体的保护作用已经被广泛报道[10]。LIM等[11]研究表明,klotho通过抑制氧化应激、RAS激活和改善线粒体功能发挥肾脏保护作用。另有研究表明,klotho过表达转基因小鼠的锰超氧化物歧化酶(MnSOD)表达量升高[12-13],从而起到抑制氧化应激的作用。然而有研究表明,当机体出现氧化应激时,klotho基因在肾脏的转录及表达均减少[4]。ROS的产生是阿霉素肾病模型大鼠肾脏损伤的主要原因,因此,抑制氧化应激不仅可减轻其对肾脏的损伤还可提高klotho基因在肾小管上皮细胞的表达,从而起到保护肾脏的作用。
研究表明,肾脏RAS过度激活与许多肾脏疾病有关,RAS过度激活的主要效应包括氧化应激、NF-κB激活、纤维母细胞增殖及细胞外基质过度沉积等[14]。血管紧张素转化酶抑制剂(ACEI)类药物具有降血压、减少尿蛋白及保护肾脏的作用,其减少尿蛋白的主要机制为阻断RAS,减少血管紧张素Ⅱ(AngⅡ)的产生。本研究以Wistar大鼠作为研究对象,采用一次性尾静脉注射阿霉素方法建立阿霉素肾病模型,模型大鼠分别给予奥美沙坦酯和他克莫司治疗12周,结果显示,奥美沙坦酯组和他克莫司组24h尿蛋白定量均较ADR组明显降低,证明奥美沙坦酯及他克莫司均具有减少尿蛋白的作用,这与既往的研究结论一致[15-16]。且他克莫司减少尿蛋白的疗效优于奥美沙坦酯。ACEI类药物可减少AngⅡ的产生,也具有抗氧化的作用。局部AngⅡ与血管紧张素Ⅱ1型受体(AngⅡ1)结合后可激活NADH/NADPH氧化酶,使O2-、H2O2等ROS类物质生成增多。AngⅡ还可作用于血管内皮细胞,刺激其产生ROS增加,从而使血浆氧化应激水平升高[17-18]。本研究结果显示,在分别给予奥美沙坦酯和他克莫司治疗4、8及12周后,奥美沙坦酯组及他克莫司组氧化应激反应均较模型组明显减弱,且他克莫司减弱氧化应激的作用较奥美沙坦酯更加明显,表明他克莫司能有效减轻氧化应激对肾脏的损害,其对肾脏的保护作用优于奥美沙坦酯。有动物实验结果表明,AngⅡ可下调klotho在肾脏中的表达[19]。糖尿病肾病大鼠给予缬沙坦治疗后,其肾脏组织中klotho蛋白表达水平升高而氧化应激反应降低[15]。另有研究表明,在慢性肾衰竭病人体内,klotho的表达量明显下降,RAS和氧化应激激活可抑制klotho在肾脏表达[20]。其机制可能是klotho通过抑制胰岛素样/胰岛素样生长因子-1介导的FoxO磷酸化而活化FoxO转录因子[21-22],去磷酸化的FoxO能够反过来上调抗氧化酶如过氧化氢酶-1和SOD的表达。本研究结果显示,在实验第4周末,ADR组大鼠肾组织中klotho的表达开始降低,第8、12周末降低更加明显;分别给予奥美沙坦酯和他克莫司灌胃治疗后,模型大鼠klotho的表达升高。实验第4、8、12周末,OLM组和FK506组大鼠肾组织中klotho的表达均较ADR组显著增加,且FK506组较OLM组增加更加明显。
综上所述,阿霉素肾病大鼠klotho表达下降与肾病综合征的发生、发展密切相关;在阿霉素肾病大鼠模型中,奥美沙坦酯和他克莫司均具有抑制氧化应激反应、提高肾组织中klotho表达进而达到保护肾脏的作用,但他克莫司保护肾脏的作用优于奥美沙坦酯。这两种药物的长期疗效、安全性及肾脏保护作用的具体分子机制目前尚不清楚,还需进一步研究。
| [1] |
YILMAZ M I, SIRIOPOL D, SAGLAM M, et al. Osteoprotegerin in chronic kidney disease:associations with vascular damage and cardiovascular events[J]. Calcified Tissue International, 2016, 99(2): 121-130. DOI:10.1007/s00223-016-0136-4 |
| [2] |
KURO-O M, MATSUMURA Y, AIZAWA H, et al. Mutation of the mouse klotho gene leads to a syndrome resembling ageing[J]. Nature, 1997, 390(6655): 45-51. DOI:10.1038/36285 |
| [3] |
MITANI H, ISHIZAKA N, AIZAWA T, et al. In vivo klotho gene transfer ameliorates angiotensin Ⅱ-induced renal damage[J]. Hypertension, 2002, 39(4): 838-843. DOI:10.1161/01.HYP.0000013734.33441.EA |
| [4] |
徐辰. KLOTHO基因介导钙磷代谢与慢性肾脏病关系的研究进展[J]. 国际泌尿系统杂志, 2012, 32(5): 692-695. |
| [5] |
卢晓梅, 马玲, 于艳秋. 奥美沙坦酯对慢性心力衰竭小鼠肾脏氧化应激的作用[J]. 中华肾脏病杂志, 2011, 27(3): 190-193. |
| [6] |
张勇, 张蓓, 宁华英, 等. 单次尾静脉注射法阿霉素大鼠肾病模型的建立[J]. 中国实验动物学报, 2013, 21(1): 1-4, 107. |
| [7] |
QI X M, WANG J, XU X X, et al. FK506 reduces albuminuria through improving podocyte nephrin and podocin expression in diabetic rats[J]. Inflammation Research, 2016, 65(2): 103-114. DOI:10.1007/s00011-015-0893-y |
| [8] |
PAVENSTADT H, KRIZ W, KRETZLER M. Cell biology of the glomerular podocyte[J]. Physiological Reviews, 2003, 83(1): 253-307. DOI:10.1152/physrev.00020.2002 |
| [9] |
VALKO M, RHODES C J, MONCOL J, et al. Free radicals, metals and antioxidants in oxidative stress-induced cancer[J]. Chemico-Biological Interactions, 2006, 160(1): 1-40. DOI:10.1016/j.cbi.2005.12.009 |
| [10] |
XIAO Nengming, ZHANG Yanming, ZHENG Quan, et al. Klotho is a serum factor related to human aging[J]. Chinese Medical Journal, 2004, 117(5): 742-747. |
| [11] |
LIM S C, LIU J J, SUBRAMANIAM T, et al. Elevated circulating alpha-klotho by angiotensin Ⅱ receptor blocker losartan is associated with reduction of albuminuria in type 2 diabetic patients[J]. Journal of the Renin-Angiotensin-Aldosterone System, 2014, 15(4): 487-490. DOI:10.1177/1470320313475905 |
| [12] |
JIN J, JIN L, LIM S W, et al. Klotho deficiency aggravates tacrolimus-induced renal injury via the phosphatidylinositol 3-kinase-Akt-forkhead box protein O pathway[J]. American Journal of Nephrology, 2016, 43(5): 357-365. DOI:10.1159/000446447 |
| [13] |
YAMAMOTO M, CLARK J D, PASTOR J V, et al. Regulation of oxidative stress by the anti-aging hormone Klotho[J]. Journal of Biological Chemistry, 2005, 280(45): 38029-38034. DOI:10.1074/jbc.M509039200 |
| [14] |
贺明, 陆利民, 姚泰. 肾素-血管紧张素系统在调节肾脏活动和慢性肾功能不全中的作用[J]. 生理科学进展, 2004, 35(2): 188-192. |
| [15] |
武晓碧, 汪晓霞, 张希尧, 等. 缬沙坦对糖尿病大鼠klotho蛋白及氧化应激影响的研究[J]. 中国糖尿病杂志, 2017, 25(8): 733-736. |
| [16] |
SHEN Xiujin, JIANG Hong, YING Meike, et al. Calcineurin inhibitors cyclosporin A and tacrolimus protect against podocyte injury induced by puromycin aminonucleoside in rodent models[J]. Scientific Reports, 2016, 6(6): 32087-32116. |
| [17] |
HAUGEN E N, CROATT A J, NATH K A. Angiotensin Ⅱ induces renal oxidant stress in vivo and heme oxygenase-1 in vivo and in vitro[J]. Kidney International, 2000, 58(1): 144-152. DOI:10.1046/j.1523-1755.2000.00150.x |
| [18] |
常洁, 姜宗培, 张海燕, 等. NADPH氧化酶介导血管紧张素Ⅱ诱导的腹膜间皮细胞转分化及细胞外基质积聚[J]. 中华肾脏病杂志, 2007, 23(5): 328-333. |
| [19] |
YOON H E, GHEE J Y, PIAO S, et al. Angiotensin Ⅱ blockade upregulates the expression of Klotho, the anti-ageing gene, in an experimental model of chronic cyclosporine nephropathy[J]. Nephrology Dialysis Transplantation, 2011, 26(3): 800-813. DOI:10.1093/ndt/gfq537 |
| [20] |
DEVARAJ S, SYED B, CHIEN A, et al. Validation of an immunoassay for soluble klotho protein decreased levels in diabetes and increased levels in chronic kidney disease[J]. American Journal of Clinical Pathology, 2012, 137(3): 479-485. DOI:10.1309/AJCPGPMAF7SFRBO4 |
| [21] |
SENGUPTA A, MOLKENTIN J D, PAIK J H, et al. FoxO transcription factors promote cardiomyocyte survival upon induction of oxidative stress[J]. The Journal of Biological Chemistry, 2011, 286(9): 7468-7478. DOI:10.1074/jbc.M110.179242 |
| [22] |
GREER E L, BRUNET A. FOXO transcription factors at the interface between longevity and tumor suppression[J]. Oncogene, 2005, 24(50): 7410-7425. DOI:10.1038/sj.onc.1209086 |
 2019, Vol. 55
2019, Vol. 55

