急性胰腺炎是以胰腺局部炎症反应为主要特征的一种临床常见病,其发病率近年来呈上升趋势,而且有部分病人可以进展为重症急性胰腺炎(SAP)。SAP具有疾病进展快、并发症多、预后差等特点[1],其主要死因是多器官功能障碍综合征,在胰腺外器官损伤中,急性呼吸窘迫综合征、急性肾衰竭等已多见文献报道[2],但对SAP并发心肌损伤仍然缺乏系统的研究。SAP并发心肌损伤是严重的并发症之一,目前认为心肌细胞损伤的发生可能与炎症递质有关[3]。约60%的急性胰腺炎病人的腹痛症状局限于上腹部,其他疾病可能会有相同的症状,如急性冠状动脉综合征[4],故医生在接诊病人时通常会进行排除诊断。高敏肌钙蛋白T(hsTnT)是由心肌细胞损伤产生的一种标志物,较其他指标出现时间更早,一旦心肌细胞发生破裂或坏死就会释放于血液中,其对判断心肌缺血损伤具有高度特异性和敏感性[5-6]。降钙素原(PCT)和白细胞介素-6(IL-6)临床上常用于辅助诊断感染性疾病。急性胰腺炎病人血PCT及IL-6水平明显升高,其升高程度是判断急性胰腺炎严重程度的重要指标[7-9]。有研究报道,SAP病人血hsTnT水平升高可能与急性胰腺炎损伤的严重程度及预后相关[10]。但是关于急性胰腺炎病人PCT、IL-6及hsTnT的时相性改变及3项指标与SAP的关系则很少有研究报道。本文分析不同严重程度急性胰腺炎病人血清PCT、IL-6以及hsTnT水平的动态变化,并探讨其临床意义。
1 对象与方法 1.1 对象及分组选取2016年6月—2018年6月本院收治的急性胰腺炎病人122例。入选标准:符合2013年中华医学会消化病学分会胰腺疾病学组提出的诊断标准[1],通过临床症状、体征、影像学检查及血清淀粉酶水平等检查确诊,发病至入院时间均<72 h。排除标准:合并急性心肌梗死、不稳定型心绞痛、恶性心律失常等严重心血管疾病病人;肝、肾等重要脏器功能不全者;糖尿病、恶性肿瘤、慢性炎症等全身性疾病病人。本研究获本院医学伦理委员会的批准,研究对象均知情同意。
入选122例病人中轻度急性胰腺炎(MAP)42例,中度急性胰腺炎(MSAP)39例,SAP 41例。MAP病人,男24例,女18例;年龄20~78岁,平均(52.63±11.61)岁;病因:胆源性23例,高脂血症10例,乙醇源性6例,其他3例。MSAP病人,男23例,女16例;年龄21~75岁,平均(50.72±11.77)岁;病因:胆源性20例,高脂血症9例,乙醇源性7例,其他3例。41例SAP病人,男性23例,女性18例;年龄22~76岁,平均(51.52±12.43)岁;病因:胆源性22例,高脂血症8例,乙醇源性7例,其他4例。MAP、MSAP和SAP病人年龄、性别、病因比较差异无显著性(P>0.05)。
根据是否发生感染性胰腺坏死(出现脓毒症的表现,腹部CT影像学检查提示气泡征,细针穿刺抽吸物涂片或培养发现细菌或真菌),将SAP病人分为感染组和未感染组。感染组23例,男性13例,女性10例;年龄23~76岁,平均(51.71±11.54)岁;病因:胆源性12例,高脂血症6例,乙醇源性3例,其他2例。非感染组18例,男性10例,女性8例;年龄22~73岁,平均(51.24±12.03)岁;病因:胆源性10例,高脂血症5例,乙醇源性2例,其他1例。感染组和非感染组病人年龄、性别和病因比较差异无统计学意义(P>0.05)。
1.2 研究方法病人住院后严格根据指南给予禁食禁水、液体复苏、胃肠减压、抑酸、抑酶、抗生素及静脉营养支持等综合内科治疗。病人分别于入院第1、3、7天采集空腹静脉血5 mL,以3 000 r/min离心15 min后分离血清,置于-20 ℃冰箱内保存。血清IL-6的测定采用酶联免疫吸附试验法,试剂盒由上海吉泰依科赛生物科技有限公司提供;血清PCT和hsTnT的测定采用电化学发光法,试剂盒由罗氏制药有限公司提供。所有样本的检测均严格按照试剂盒的说明进行操作。同时统计所有入选病人入院72 h内急性生理和慢性健康评分系统Ⅱ(APACHEⅡ)评分、CT严重程度指数(CTSI)评分的最高值。比较不同组间病人血清PCT、IL-6和hsTnT水平,对指标间的相关性进行Pearson相关分析,并用ROC曲线分析上述3个指标对SAP的预测能力。
1.3 统计学方法采用SPSS 22.0软件进行统计学分析。正态分布的计量资料数据以x±s表示,进行方差齐性检验后,组间比较采用独立样本t检验、重复测量方差分析;计数资料组间比较采用卡方检验;指标间的相关性分析采用Pearson相关分析;对疾病严重程度预测有效性采用ROC曲线进行分析。
2 结果 2.1 不同严重程度急性胰腺炎病人血清PCT、IL-6和hsTnT水平比较不同严重程度急性胰腺炎组间血清PCT、IL-6和hsTnT水平比较差异有显著性(F组别=20.162~154.311,P<0.05),不同时间血清PCT、IL-6和hsTnT水平比较差异亦有显著性(F时间=4.905~123.279,P<0.05),组别和时间有交互效应(F交互=10.407~36.327,P<0.05)。MAP、MSAP和SAP病人入院第3天血清PCT、IL-6和hsTnT水平均较入院第1天升高,并达到峰值,第7天仍高于第1天。SAP病人不同时间血清PCT、IL-6和hsTnT水平均较MAP、MSAP病人显著增高,差异有显著性(F=2.359~74.066,P<0.05)。见表 1。
| 表 1 不同严重程度急性胰腺炎病人血清PCT、IL-6和hsTnT水平比较(x±s) |
|
|
MAP、MSAP、SAP病人入院后72 h内进行的APACHEⅡ评分最高值分别为3.44±2.71、6.73±3.62和17.65±8.18,CTSI评分的最高值则分别为1.97±1.21、3.61±1.44和5.72±2.01。Pearson相关分析显示,SAP病人的血清PCT、IL-6水平以及APACHEⅡ、CTSI评分均与血清hsTnT水平均呈正相关(r=0.673~0.787,P<0.05)。
2.3 感染组和非感染组SAP病人血清PCT、IL-6和hsTnT水平比较感染组和非感染组SAP病人血清PCT、IL-6和hsTnT水平比较差异有显著性(F组别=25.891~46.873,P<0.05),不同时间比较差异亦有统计学意义(F时间=28.904~102.379,P<0.05),组别和时间存在交互效应(F交互=14.671~23.185,P<0.05)。感染组各时间点的血清PCT、IL-6及hsTnT水平均显著高于非感染组(F=11.072~126.414,P<0.05)。见表 2。
| 表 2 感染组和非感染组SAP病人血清PCT、IL-6和hsTnT水平比较(x±s) |
|
|
各指标中,hsTnT对SAP的预测能力最强,其ROC曲线下面积(AUC)为0.892;IL-6对SAP的预测能力最弱,其AUC为0.782。见表 3、图 1。建立两个模型来进一步评估联合检测对SAP的预测价值,将IL-6、PCT及hsTnT作为新指标联合检测,其AUC为0.935;将APACHEⅡ评分、CTSI评分作为传统指标联合检测,其AUC为0.917。新指标联合检测对SAP的预测能力较传统指标联合检测明显增加,表明IL-6、PCT及hsTnT联合检测对SAP的预测价值更大。见表 3、图 2。
| 表 3 各指标对SAP的预测能力 |
|
|
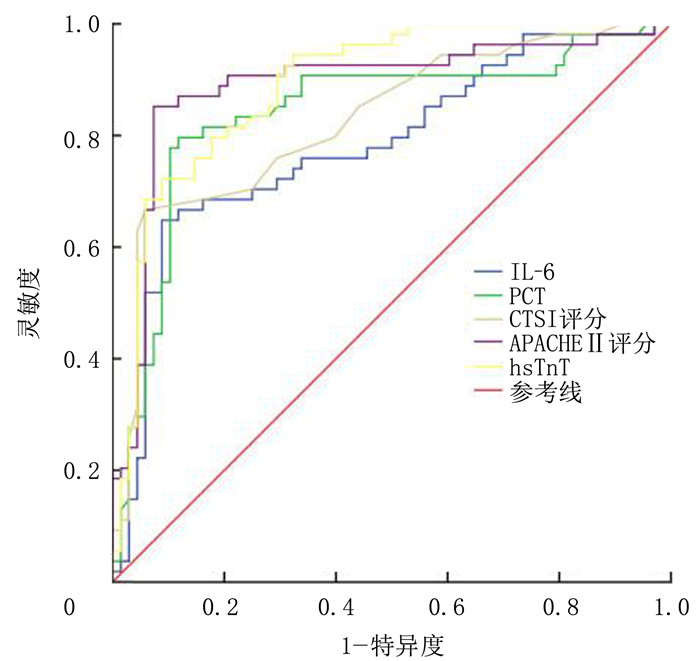 |
| 图 1 血清IL-6、PCT、hsTnT、APACHEⅡ评分及CTSI评分预测SAP的ROC曲线 |
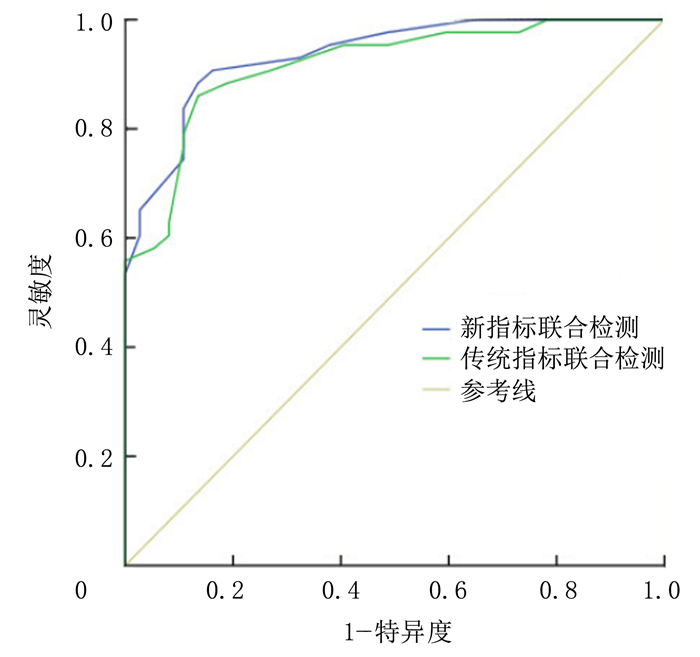 |
| 图 2 新指标联合检测和传统指标联合检测预测SAP的ROC曲线 |
急性胰腺炎是多种因素参与的炎症性疾病,可以分为MAP、MSAP和SAP,其中SAP病人约占20%[11]。近年来急性胰腺炎的发病率仍在升高,治疗水平虽也在相应提高,但SAP的病死率并未得到改善[12]。尽管胰腺炎的发病机制尚未完全阐明,但相关研究认为,无论何种胰腺炎,均存在多种细胞因子介导的炎症反应,特别是SAP,早期强烈的过度炎症反应和死亡密切相关[13-15]。在SAP的后期,死于多器官功能衰竭和脓毒症的病人占80%以上,而发生多器官功能衰竭和脓毒症与胰腺及其周围组织坏死、继发感染等有着密切的关系[16-17]。
本文研究结果显示,不同严重程度急性胰腺炎病人血清PCT、IL-6、hsTnT水平均在入院第3天达到高峰,之后逐渐下降。与MAP和MSAP病人相比,SAP病人入院第1、3、7天血清PCT、IL-6、hsTnT水平显著升高,说明血清PCT、IL-6、hsTnT水平可作为评估胰腺炎严重程度的重要指标。SAP感染组各时间点血清PCT、IL-6及hsTnT水平均高于未感染组,差异具有统计学意义,说明及时监测上述指标可在早期及时判断出病人是否存在感染,有利于做出针对性治疗。胰腺炎病人血清PCT、IL-6、hsTnT水平动态变化之间存在一致性。本文Pearson相关分析显示,SAP病人血清PCT、IL-6水平及APACHEⅡ、CTSI评分与血清hsTnT水平之间存在不同程度的正相关关系。表明SAP病人的病情严重程度和心肌损伤之间存在着较大的相关性,随着病人病情加重,其心肌损伤程度也增加。SAP病人的病程中常伴有心肌损伤和心功能的改变,表现为心律失常、心功能不全等。胰腺炎的早期,胰腺释放多种细胞因子和炎症递质,炎症指标(如PCT、IL-6等)随之升高[18-19]。随着炎症递质的进一步释放,可能会引发全身的炎症反应,并导致心脏微循环功能障碍,造成心肌细胞的损伤和凋亡,引起心肌酶水平的升高。心肌损伤严重的病人会出现心功能不全,加重全身循环缺血低氧的情况,造成病情进一步恶化,甚至可能出现多器官功能衰竭[20]。
SAP具有发病急、进展迅速和病死率高的特点,因此尽早对病人的病情进行判断和预测对指导疾病治疗、提高病人生存质量、改善远期预后有重要的意义。目前评估胰腺炎严重程度的方法有多种。根据最新指南推荐,联合APACHEⅡ评分及CTSI评分仍然是目前评估急性胰腺炎严重程度的最佳手段[1]。本研究结果显示,APACHEⅡ评分对SAP的预测能力高于CTSI评分,与有关的研究结果一致[21]。APACHEⅡ评分是预测准确性最高的评分系统,被多项指南所推荐,可以客观地反映重症病人的病情,并可以动态评估急性胰腺炎的病情,但有研究者认为该评分系统的项目过于复杂且缺乏特异性[22-24]。CTSI评分是目前使用最广泛的影像评分系统,但不能有效反映病人的全身状态,可造成病情的延误,反复CT增强扫描不便捷、费用高,甚至可能加重病情,而且它在预测器官功能障碍方面灵敏度较低[21, 25]。因此,临床上需要一种更为简单快捷的方式来评估胰腺炎病情严重程度。
PCT作为一种炎症递质,稳定性好,而且有较高的灵敏度和特异度,是筛查感染性疾病和鉴别不同病原菌感染的良好指标[26]。IL-6是炎症刺激下多种细胞合成的重要的促炎因子,在胰腺炎的早期开始升高,而且持续时间与SAP病情的严重程度呈正相关,可作为早期衡量胰腺炎严重程度的标志之一[27]。hsTnT是横纹肌兴奋收缩的主要调节蛋白,只存在于心肌细胞中,是临床用于判断心脏损伤程度的重要指标,其能否用于评估SAP病人的预后目前国内外相关文献较少。本文ROC曲线分析表明,血清PCT、IL-6和hsTnT水平均对SAP有一定的预测价值,并且与传统指标效果相当。三者中hsTnT对SAP预测能力最强,PCT对SAP预测能力中等,IL-6对SAP预测能力最弱。虽然联合进行APACHEⅡ评分及CTSI评分的预测能力优于PCT和IL-6检测,但由于其评估项目比较复杂,指标繁多,不易掌握,一定程度上限制了其临床应用。进一步的分析显示,相较于传统指标(APACHEⅡ评分及CTSI评分)联合检测,PCT、IL-6和hsTnT联合检测对SAP有更高的预测能力(AUC=0.935 vs AUC=0.917),说明血清PCT、IL-6和hsTnT水平联合检测可作为评估SAP严重程度的重要指标。血清PCT、IL-6和hsTnT水平联合检测用于评估急性胰腺炎的优势为:①相较于APACHEⅡ评分及CTSI评分,只需3个指标就可以评估急性胰腺炎病情,指标获取方便,简单快捷,容易推广;②急性胰腺炎病人早期进行血清PCT、IL-6和hsTnT水平的检测,可以预测是否发生感染及疾病进展,便于积极进行早期预防和对症治疗,最大限度控制病情和改善SAP病人的预后。
本研究由于实验条件所限,未追踪病人30 d病死率,没有对病人的结局情况进行进一步的讨论。另外,PCT、IL-6和hsTnT无法24 h实时监测,是对病情横断面的评估,时效性较APACHEⅡ评分还有不足。由于本研究数据是单中心数据(各医院之间急性胰腺炎严重程度可能会不尽相同),且样本量有限,尚需要多中心大样本的研究来进一步证实。尽管如此,本研究的数据仍具有一定的参考价值,对临床治疗有一定的指导意义。
综上所述,与MAP和MASP病人相比,SAP病人血清PCT、IL-6和hsTnT水平均明显升高,三者水平的动态监测在急性胰腺炎的早期判断中具有重要临床价值,三者水平的变化有助于对病情程度的判断和疾病预后的评估。
| [1] |
中华医学会消化病学分会胰腺疾病学组, 《中华胰腺病杂志》编辑委员会, 《中华消化杂志》编辑委员会. 中国急性胰腺炎诊治指南(2013年, 上海)[J]. 临床肝胆病杂志, 2013, 29(9): 656-660. DOI:10.3969/j.issn.1001-5256.2013.09.006 |
| [2] |
KIM Y J, KIM D B, CHUNG W C, et al. Analysis of factors influencing survival in patients with severe acute pancreatitis[J]. Scandinavian Journal of Gastroenterology, 2017, 52(8): 904-908. DOI:10.1080/00365521.2017.1310291 |
| [3] |
WANG Yayun, CHEN Manhua. Fentanyl ameliorates severe acute pancreatitis-induced myocardial injury in rats by regulating NF-kappa B signaling pathway[J]. Medical Science Monitor, 2017, 23: 3276-3283. DOI:10.12659/MSM.902245 |
| [4] |
PEZZILLI R, BELLACOSA L, BARAKAT B. Abdominal pain and ECG alteration: a simple diagnosis?[J]. Advances in Medical Sciences, 2010, 55(2): 333-336. DOI:10.2478/v10039-010-0016-5 |
| [5] |
AGEWALL S, GIANNITSIS E, JERNBERG T, et al. Troponin elevation in coronary vs. non-coronary disease[J]. European Heart Journal, 2011, 32(4): 404-411. DOI:10.1093/eurheartj/ehq456 |
| [6] |
HUANG Liya, MA Binwu, HE Fang, et al. Electrocardiographic, cardiac enzymes, and magnesium in patients with severe acute pancreatitis[J]. Gastroenterology Nursing, 2012, 35(4): 256-260. DOI:10.1097/SGA.0b013e31826092a6 |
| [7] |
RICHÉ F C, CHOLLEY B P, LAISNÉ M J, et al. Inflammatory cytokines, C reactive protein, and procalcitonin as early predictors of necrosis infection in acute necrotizing pancreatitis[J]. Surgery, 2003, 133(3): 257-262. DOI:10.1067/msy.2003.70 |
| [8] |
COVINGTON E W, ROBERTS M Z, DONG J. Procalcitonin monitoring as a guide for antimicrobial therapy: a review of current literature[J]. Pharmacotherapy, 2018, 38(22): 132-134. |
| [9] |
RAO S A, KUNTE A R. Interleukin-6: an early predictive marker for severity of acute pancreatitis[J]. Indian Journal of Critical Care Medicine, 2017, 21(7): 424-428. DOI:10.4103/ijccm.IJCCM_478_16 |
| [10] |
CHACON-PORTILLO M A, PAYRO-RAMIREZ G, PELAEZLUNA M C, et al. Abnormal cardiovascular findings in acute pancreatitis: are they associated with disease severity?[J]. Revista Investigacion Clinica, 2017, 69(6): 314-318. |
| [11] |
BANKS P A, BOLLEN T L, DERVENIS C, et al. Classification of acute pancreatitis—2012: revision of the Atlanta classification and definitions by international consensus[J]. Gut, 2013, 62(1): 102-111. DOI:10.1136/gutjnl-2012-302779 |
| [12] |
王春亭, 曲鑫. 重症急性胰腺炎的诊治进展[J]. 中华急诊医学杂志, 2012, 21(10): 1080-1083. DOI:10.3760/cma.j.issn.1671-0282.2012.10.002 |
| [13] |
LI Lei, SUN Zhongwei, XU Caiming, et al. Adenovirus-mediated overexpression of sST2 attenuates cardiac injury in the rat with severe acute pancreatitis[J]. Life Sciences, 2018, 202: 167-174. DOI:10.1016/j.lfs.2018.04.008 |
| [14] |
MEYER A, KUBRUSLY M S, SALEMI V M, et al. Severe acute pancreatitis: a possible role of intramyocardial cytokine production[J]. Journal of the Pancreas, 2014, 15(3): 237-242. |
| [15] |
WAN Jianhua, CHEN Jie, WU Dangyan, et al. Regulation of autophagy affects the prognosis of mice with severe acute pancreatitis[J]. Digestive Diseases and Sciences, 2018, 63(10): 2639-2650. DOI:10.1007/s10620-018-5053-0 |
| [16] |
CHANG Kai, LU Weiping, ZHANG Kejun, et al. Rapid urinary trypsinogen-2 test in the early diagnosis of acute pancreatitis: a meta-analysis[J]. Clinical Biochemistry, 2012, 45(13/14): 1051-1056. |
| [17] |
陈其奎. 急性胰腺炎与全身炎性反应综合征、多器官功能衰竭的关系及其防治策略[J]. 中华消化杂志, 2016, 36(10): 656-658. DOI:10.3760/cma.j.issn.0254-1432.2016.10.004 |
| [18] |
PHADKE M S, PUNJABI P, SHARMA S, et al. Acute pancreatitis complicated by ST-elevation myocardial infarction[J]. The Journal of Emergency Medicine, 2013, 44(5): 932-935. DOI:10.1016/j.jemermed.2011.06.139 |
| [19] |
UVELIN A, HAJDUKOVIC D, VRSAJKOV V, et al. A case of recurrent arrhythmia in an acute pancreatitis patient—pathophysiological explanation using shortage of 'repolarization reserve'[J]. Acta Clinica Croatica, 2013, 52(4): 515-522. |
| [20] |
CHEN Xin, ZHU Bin. Steroid receptor coactivator-interacting protein (SIP) suppresses myocardial injury caused by acute pancreatitis[J]. Medical Science Monitor, 2018, 24: 3204-3211. DOI:10.12659/MSM.906968 |
| [21] |
KHANNA A K, MEHER S, PRAKASH S, et al. Comparison of Ranson, Glasgow, MOSS, SIRS, BISAP, APACHE-Ⅱ, CTSI scores, IL-6, CRP, and procalcitonin in predicting severity, organ failure, pancreatic necrosis, and mortality in acute pancreatitis[J]. HPB Surgery, 2013, 2013: 367581. |
| [22] |
陈莉, 邓立普, 赵红梅, 等. NEWS、REMS和APACHEⅡ评分对急诊危重患者预后评估的对比研究[J]. 中华危重病急救医学, 2017, 29(12): 1092-1096. DOI:10.3760/cma.j.issn.2095-4352.2017.12.008 |
| [23] |
GODINJAK A, IGLICA A, RAMA A, et al. Predictive value of SAPS Ⅱ and APACHE Ⅱ scoring systems for patient outcome in medical intensive care unit[J]. Acta Medica Academica, 2016, 45(2): 97-103. |
| [24] |
刘纪, 张生雷, 茅一萍, 等. ASIS和APACHEⅡ评分对重症患者病情严重程度评估作用的研究[J]. 中华医院感染学杂志, 2018, 28(8): 1195-1198. |
| [25] |
RAGHUWANSHI S, GUPTA R, VYAS M M, et al. CT evaluation of acute pancreatitis and its prognostic correlation with CT severity index[J]. Journal of Clinical & Diagnostic Research, 2016, 10(6): TC06-TC11. |
| [26] |
徐益萍, 骆方军, 郑军, 等. 重症急性胰腺炎患者血清降钙素原与C-反应蛋白测定的临床价值[J]. 中华医院感染学杂志, 2017, 27(5): 1089-1092. |
| [27] |
KUULIALA K, PENTTILA A K, KAUKONEN K M, et al. Signalling profiles of blood leucocytes in sepsis and in acute pancreatitis in relation to disease severity[J]. Scandinavian Journal of Immunology, 2018, 87(2): 88-98. DOI:10.1111/sji.12630 |
 2019, Vol. 55
2019, Vol. 55

