扁平苔癣(LP)原发损害为多角形扁平丘疹,好发于四肢伸侧、躯干以及颈背部,往往伴有瘙痒,给病人带来很大的苦恼[1]。研究显示,LP是多种机制共同作用导致的免疫炎性疾病。近年来越来越多的研究表明,低氧环境下诱导的低氧诱导因子(HIF)在免疫炎症反应中发挥着重要作用[2]。基质金属蛋白酶家族(MMPs)是以锌离子为锚定结构的内肽酶家族,参与几乎所有细胞的生化反应,其中的基质金属蛋白酶-2(MMP-2)可特异性水解Ⅳ型胶原。皮肤表皮基底层主要成分为Ⅳ型胶原,MMP-2平衡失代偿会导致基底层液化变性[3]。既往多项研究显示,葡萄糖转运因子-1(GLUT-1)是受HIF-1调控的靶基因之一, 低氧环境下HIF-1蛋白表达增高,并诱导下游因子GLUT-1蛋白表达,二者均参与细胞低氧调控的生化反应以适应低氧环境[4-5]。本文研究应用免疫组织化学方法,检测HIF-1α、GLUT-1、MMP-2在正常皮肤组织、LP皮损组织中的表达情况,探讨三者在LP中的表达及其之间是否存在相关性。现将结果报告如下。
1 材料与方法 1.1 标本及其来源2015年7月—2017年7月,收集我院黄岛院区皮肤科诊治的LP病人皮损组织45例,均经病理检查确诊。其中男24例,女21例;年龄20~60岁,平均(37.2±10.0)岁;病程3月~15年,平均10.33月。另取本院同期外科手术后病人的正常皮肤组织35例,其中男17例,女18例;年龄22~60岁,平均(38.5±10.0)岁。两组年龄、性别差异无显著性。所取标本均用40 g/L甲醛固定不超过24 h, 石蜡包埋,切片。
1.2 主要试剂兔抗人HIF-1α多克隆抗体、兔抗人MMP-2多克隆抗体、兔抗人GLUT-1均购自青岛云山公司;SP试剂盒购自福建迈新生物技术公司;通用型二抗(PV-6001)、二氨基联苯胺试剂购自北京中杉金桥生物技术有限公司。
1.3 检测指标及方法将组织切片置于烘片机中烘烤1 h,缓冲液冲洗3次, 微波抗原修复20 min, 加入30 g/L过氧化物酶1孵育10 min,微波加热修复2 min,分别滴加一抗HIF-1α、MMP-2及GLUT-1(滴度分别为1:200, 1:75和1:150), 37 ℃水浴1 h,加入通用型二抗PV-6001,置37 ℃恒温箱45 min。阳性对照采用自身对照,阴性对照采用PBS缓冲液代替一抗。光镜下观察染色情况。
1.4 结果判断HIF-1α和GLUT-1染色结果判定:随机取切片四角及中央10个高倍视野进行观察。细胞染色强度评分:3分,棕褐色染色;2分,棕黄色染色;1分,浅黄色染色;0分,细胞无显色。再对阳性细胞百分比评分:< 30%为1分;30%~70%为2分,>70为3分。根据染色强度和阳性细胞百分比评分相乘得分评定结果,< 1分为阴性表达(-),≥1分为阳性表达(+)。MMP-2染色结果评定:阳性细胞百分数 < 10%为阴性(-),≥10%为阳性(+)。
1.5 统计学方法采用SPSS 24.0软件进行统计学处理,计数资料比较采用χ2检验;相关性分析采用Spearman法。P < 0.05为差异有统计学意义。
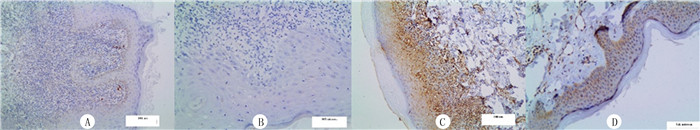
2 结果 2.1 两组MMP-2表达比较LP皮损组织中MMP-2阳性染色主要表现为表皮基底层细胞浆中出现棕黄色颗粒沉淀,对照组表皮无明显染色或者可见淡黄色沉淀(图 1)。LP皮损组织中39例MMP-2阳性表达,表达阳性率为86.6%,高于正常皮肤组织(31.5%),差异有统计学意义(χ2=26.58,P<0.05)。
 |
| A、B:正常上皮组织(SP染色,分别放大100、200倍);C、D:LP上皮组织(SP染色,分别放大100、200倍)。 图 1 MMP-2在正常组织和LP上皮组织中的表达 |
LP皮损组织中GLUT-1阳性染色主要表现为基底层棕黄色颗粒沉淀,棘层及真皮浅层淋巴细胞亦出现阳性染色,棕黄色染色主要定位于细胞膜和极少量细胞浆;对照组无明显着色(图 2)。LP皮损组织中有40例GLUT-1阳性表达,表达阳性率为88.9%,高于正常皮肤组织(20.0%),两组比较差异有统计学意义(χ2=40.00,P<0.05)。
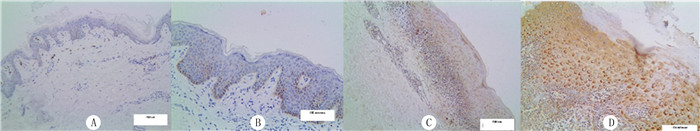 |
| A、B:正常上皮组织(SP染色,分别放大100、200倍);C、D:LP上皮组织(SP染色,分别放大100、200倍)。 图 2 正常组织和LP上皮组织中GLUT-1表达 |
HIF-1α阳性染色为基底层细胞及真皮浅层淋巴细胞胞核出现棕黄色颗粒,主要定位于核膜(图 3)。正常皮肤组织中HIF-1α不表达或少量表达;LP皮损组织中39例HIF-1α阳性表达,表达阳性率为86.7%,两组比较差异有显著意义(χ2=23.74,P<0.05)。
 |
| A、B:正常上皮组织(SP染色,分别放大100、200倍);C、D:LP上皮组织(SP染色,分别放大100、200倍)。 图 3 正常组织和LP上皮组织中HIF-1α表达 |
LP皮损组织中HIF-1α与GLUT-1表达呈正相关(r=0.98,P<0.05),GLUT-1与MMP-2表达呈正相关(r=0.99, P<0.05),HIF-1α与MMP-2表达呈正相关(r=0.99,P<0.05)。
3 讨论近年来研究表明,低氧微环境在免疫炎性疾病发生、发展中起重要作用[6]。有研究显示,因炎症因子刺激,皮肤免疫性疾病微环境常处于低氧状态,微环境低氧会使机体产生保护性生理生化反应以维持血氧稳定。
HIF-1α作为低氧刺激下的主要的诱导反应蛋白,几乎可产生于任何细胞,其主要作用包括提高代谢水平、维持血氧稳定以及促进生理生化反应增加氧含量[7]。同时,免疫炎性反应因子可通过MAPK等信号通路,间接地诱导HIF-1α高表达[8]。推测HIF-1α和其诱导的下游因子的协同作用可导致上皮细胞增殖和凋亡的失衡,但机制还有待进一步研究[9-10]。本文研究结果显示,LP组HIF-1α表达阳性率及染色程度较正常对照组显著增高,推测HIF-1α在LP的发生、发展中可能发挥重要作用。
GLUT-1是葡萄糖转运蛋白主要反应元件,存在于各类细胞中,低氧、应激反应等可诱导GLUT-1蛋白表达,在低氧状态下可被HIF-1α转录激活,调节下游因子,进而调控低氧状态下细胞生理生化反应,促进细胞糖代谢和糖酵解,使细胞获得更多能量来适应低氧的不利环境[11-12]。有研究显示, GLUT-1蛋白在正常及良性上皮肿瘤中未见表达,而在肺癌、乳癌等恶性肿瘤中高表达[13]。另有研究显示,体外低氧刺激细胞或者肿瘤细胞可激发与糖酵解相关酶和蛋白质明显升高,其中GLUT-1可见显著升高[14]。另有作者对卵巢癌组织研究发现,GLUT-1过表达在一定程度受HIF-1α调控,并且低氧环境可直接诱发GLUT-1的表达[15-16]。本文研究结果显示,LP皮损组织中GLUT-1表达阳性率高于正常皮肤组织,差异有显著性,推测GLUT-1在LP的发生、发展中可能有着重要的作用。
LP皮损组织上皮基膜和基底层角质形成细胞的锚定成分被破坏,从而导致上皮组织和其他连接的组织之间出现裂隙,这层连接组织主要成分为Ⅳ型胶原[17-18]。近年来研究显示,MMP-2在LP及银屑病等增殖性疾病中表达增高[19-20]。MMP-2及其调控因子的平衡失调,导致MMP-2降解减弱,增多的MMP-2过度破坏上皮的连接组织,从而诱发基底膜损伤,导致LP慢性发展。最新研究发现,低氧也可引起MMP-2表达增加,MMPs参与缺血低氧损伤和肿瘤的侵袭转移等许多病理生理过程[21]。HIF-1α在低氧条件下对MMP-2也有调控作用。有研究应用氯化钴模拟低氧以及降低氧分压影响脂肪细胞,结果显示,在低氧条件下MMP-2 mRNA表达明显提高,在低氧环境下HIF-1α与MMP-2可能有一定的相关性[22]。另有研究发现,低氧环境下肠癌、胃癌病人MMP-2表达较正常人高,癌组织转移能力也较正常组织高[23]。国外学者采用蛋白质印迹法、明胶酶谱等方法对纤维肉瘤组织进行定量实验显示,24 h后MMP-2 mRNA水平和细胞分泌作用显著增高[24]。本文的研究结果也显示,LP中MMP-2的表达与GLUT-1显著相关。
有研究表明,能被HIF-1α直接诱导的基因即低氧反应基因(HRG)的启动子或增强子有一个小于100 bp的DNA序列,可调控细胞对低氧的反应。而MMP-2的启动子里缺乏此序列,推测HIF-1α对MMP-2的调控机制可能为间接调控[25-26]。NING等[27]采用Western blot及酶联免疫方法研究表明,恶性肿瘤组织GLUT-1可促进MMP-2的转录活性,继而对MMP-2的表达进行正向调控。另有研究显示,恶性肿瘤细胞中GLUT-1与MMP-2表达有显著相关性[28]。ITO等[29]通过对8种肿瘤细胞系研究发现,GLUT-1与MMP-2在恶性肿瘤中表达量增高并有显著相关性,在横纹肌肉瘤中GLUT-1对MMP-2有正向调控作用并影响肿瘤细胞的侵袭力。本文研究结果显示,GLUT-1在LP组织中的表达高于正常组织,并且与MMP-2表达呈正相关关系,提示HIF-1α可能通过GLUT-1在转录水平上对MMP-2进行正向调节。
综上所述,LP皮损组织中HIF-1α、GLUT-1和MMP-2表达均增加,并且三者之间的表达呈正相关,提示HIF-1α、GLUT-1和MMP-2在LP的发病中有重要作用,但其具体机制尚需进一步研究。
| [1] |
王慧, 白莉. 扁平苔癣皮损中MIF, MMP-9的表达及意义[J]. 中国医药导报, 2010, 7(33): 13-14. DOI:10.3969/j.issn.1673-7210.2010.33.007 |
| [2] |
GRAS E, BELAIDI E, BRIANÇON-MARJOLLET A, et al. Endothelin-1 mediates intermittent hypoxia-induced inflammatory vascular remodeling through HIF-1 activation[J]. Journal of Applied Physiology, 2016, 120(4): 437-443. DOI:10.1152/japplphysiol.00641.2015 |
| [3] |
WANG Jing, LUO Hong, XIAO Yan, et al. miR-125b inhi-bits keratinocyte proliferation and promotes keratinocyte apoptosis in oral lichen planus by targeting MMP-2 expression through PI3 K/Akt/mTOR pathway[J]. Biomedicine & Pharmacotherapy, 2016, 80(80): 373-380. |
| [4] |
SELEIT I, BAKRY O A, AL-SHARAKY D R, et al. Evaluation of hypoxia inducible factor-1α and glucose transporter-1 expression in non melanoma skin cancer: an immunohistochemical study[J]. J Clin Diagn Res, 2017, 11(6): EC09-EC16. |
| [5] |
FUJINO M, AISHIMA S, SHINDO K, et al. Expression of glucose transporter-1 is correlated with hypoxia-inducible factor 1α and malignant potential in pancreatic neuroendocrine tumors[J]. Oncology Letters, 2016, 12(5): 3337-3343. DOI:10.3892/ol.2016.5092 |
| [6] |
HUANG X, HE Z, JIANG X, et al. Folic acid represses Hypoxia-induced inflammation in THP-1 cells through inhibition of the PI3K/Akt/HIF-1α pathway[J]. PLoS One, 2016, 11(3/4): e0151553. |
| [7] |
KARAGIOTA A, KOURTI M, SIMOS G, et al. HIF-1α-derived cell-penetrating peptides inhibit ERK-dependent activation of HIF-1 and trigger apoptosis of cancer cells under hypoxia[J]. Cell Mol Life Sci, 2019, 76(4): 809-825. DOI:10.1007/s00018-018-2985-7 |
| [8] |
BALAMURUGAN K. HIF-1 at the crossroads of hypoxia, inflammation, and cancer[J]. International Journal of Cancer. Journal International du Cancer, 2015, 138(5): 1058-1066. |
| [9] |
SUMI C, OKAMOTO A, TANAKA H, et al. Suppression of mitochondrial Oxygen metabolism mediated by the transcription factor HIF-1 alleviates propofol-induced cell toxicity[J]. Scientific Reports, 2018, 8(1): 8987-8988. DOI:10.1038/s41598-018-27220-8 |
| [10] |
CHOI Y K. A positive circuit of VEGF increases Glut-1 expression by increasing HIF-1α gene expression in human retinal endothelial cells[J]. Archives of Pharmacal Research, 2017, 40(12): 1433-1442. DOI:10.1007/s12272-017-0971-5 |
| [11] |
HOSSEINPOUR S, MASHHADIABBAS F, AHSAIE M G. Diagnostic biomarkers in oral verrucous carcinoma:a systema-tic review[J]. Pathology & Oncology Research, 2017, 23(1): 19-32. |
| [12] |
SHEN Lifang, ZHAO Xin, ZHOU Shuihong, et al. In vivo evaluation of the effects of simultaneous inhibition of GLUT-1 and HIF-1 alpha by antisense oligodeoxynucleotides on the radiosensitivity of laryngeal carcinoma using micro F-18-FDG PET/CT[J]. Oncotarget, 2017, 8(21): 34709-34726. |
| [13] |
CANPOLAT T, ERSÖZ C, UUZ A, et al. GLUT-1 expression in proliferative endometrium, endometrial hyperplasia, endometrial adenocarcinoma and the relationship between GLUT-1 expression and prognostic parameters in endometrial adenocarcinoma[J]. Turk Patoloji Dergisi, 2016, 32(3): 141-147. |
| [14] |
ZHANG T B, ZHAO Y, TONG Z X, et al. Inhibition of glucose-transporter 1 (GLUT-1) expression reversed Warburg effect in gastric cancer cell MKN45[J]. International Journal of Clinical and Experimental Medicine, 2015, 8(2): 2423-2428. |
| [15] |
ADACHI N, KUBOTA Y, KOSAKA K, et al. Low-dose radiation pretreatment improves survival of human ceiling culture-derived proliferative adipocytes (ccdPAs) under hypoxia via HIF-1 alpha and MMP-2 induction[J]. Biochemical and Biophysical Research Communications, 2015, 463(4): 1176-1183. DOI:10.1016/j.bbrc.2015.06.079 |
| [16] |
MAHMOUD E D, VIVEK K P V, MAHMOUD S, et al. Hyperglycaemic impairment of PAR2-mediated vasodilation: prevention by inhibition of aortic endothelial sodium-glucose-co-transporter-2 and minimizing oxidative stress[J]. Vascul Pharmacol, 2018, 109: 56-71. DOI:10.1016/j.vph.2018.06.006 |
| [17] |
NEVEEN E S, FATMA M E, HALA A T, et al. Evaluation of serum levels of neurotrophin 4 and brain-derived nerve growth factor in uremic pruritus patients[J]. Clin Cosmet Investig Dermatol, 2019, 12: 109-114. DOI:10.2147/CCID.S190917 |
| [18] |
GLAZEWSKA EK, NICZYPORUK M, ŁAWICKI S, et al. Therapy of psoriasis with narrowband ultraviolet-B light in-fluences plasma concentrations of MMP-2 and TIMP-2 in patients[J]. Ther Clin Risk Manag, 2016, 12: 1579-1585. DOI:10.2147/TCRM.S113769 |
| [19] |
JING Wanga, HONG Luob, YAN Xiao, et al. miR-125b inhibits keratinocyte proliferation and promotes keratinocyte apoptosis in oral lichen planus by targeting MMP-2 expression through PI3K/Akt/mTOR pathway[J]. Biomed Pharmaco-ther, 2016, 80: 373-380. DOI:10.1016/j.biopha.2016.02.043 |
| [20] |
DEROSA G1, ROMANO D, BIANCHI L, et al. The effects of canrenone on inflammatory markers in patients with metabolic syndrome[J]. Ann Med, 2015, 47(1): 47-52. |
| [21] |
SUN L, XIE S, JI X, et al. MMP-2-responsive fluorescent nanoprobes for enhanced selectivity of tumor cell uptake and imaging[J]. Biomaterials Science, 2018, 6(10): 2619-2626. DOI:10.1039/C8BM00593A |
| [22] |
SUN L, XIE S, JI X, et al.
|
| [23] |
YASUDA M, MIYAZAWA M, FUJITA M, et al. Expression of hypoxia inducible factor-1alpha (HIF-1alpha) and glucose transporter-1 (GLUT-1) in ovarian adenocarcinomas: difference in hypoxic status depending on histological character[J]. Oncology Reports, 2008, 19(1): 111-116. |
| [24] |
LU Shuming, ZHANG Zhuqing, CHEN Meiru, et al. Silibinin inhibits the migration and invasion of human gastric cancer SGC7901 cells by downregulating MMP-2 and MMP-9 expression via the p38MAPK signaling pathway[J]. Oncology Letters, 2017, 14(6): 7577-7582. |
| [25] |
KIM S R, EOM T K, BYUN H G. Inhibitory effect of the carnosine-gallic acid syntheticpeptide on MMP-2 and MMP-9 in human fibrosarcoma HT1080 cells[J]. Journal of PeptidScience, 2014, 20(9): 716-724. |
| [26] |
AI P, SHEN B, PAN H, et al. MiR-411 suppressed vein wall fibrosis by downregulating MMP-2 via targeting HIF-1α[J]. Journal of Thrombosis and Thrombolysis, 2018, 45(2): 264-273. DOI:10.1007/s11239-017-1596-8 |
| [27] |
NING X, WANG Y, YAN W, et al. Chitin synthesis inhibitors promote liver cancer cell metastasis via interfering with hypoxia-inducible factor 1α[J]. Chemosphere, 2018, 206: 231-237. DOI:10.1016/j.chemosphere.2018.05.014 |
| [28] |
XV Yingying, BAO Yangyang, Hong Shui, et al. Effect on the expression of MMP-2, MT-MMP in laryngeal carcinoma Hep-2 cell line by antisense glucose transporter-1[J]. Archives of Medical Research, 2012, 43(5): 395-401. DOI:10.1016/j.arcmed.2012.07.003 |
| [29] |
ITO H, DUXBURY M, ZINNER M J, et al. Glucose transporter-1 gene expression is associated with pancreatic cancer invasiveness and MMP-2 activity[J]. Surgery, 2004, 136(3): 548-556. DOI:10.1016/j.surg.2004.05.032 |
 2019, Vol. 55
2019, Vol. 55

