2. 青岛大学附属医院病理科;
3. 山东省青岛疗养院
肥厚型心肌病(HCM)是心肌病中常见的一种常染色体显性单基因遗传病,是指排除导致心肌异常因素(如瓣膜病、高血压)的原发性心肌病,以非对称性心肌肥厚、左心室腔变小的心室壁肥厚或心脏质量增加为特征[1-2]。HCM是青少年及运动员发生心源性猝死(SCD)的首要原因[3]。SCD占成年人猝死的第1位,据统计,在SCD的病因中,遗传性心肌病占5.9%~6.2%,位列第3位[4-5]。中国成年人群HCM的患病率为1/500,但由于我国是人口大国,HCM患病总数较为庞大,且该病遗传度高,大约60%的成年HCM病人可检测到明确的致病基因突变,对病人及其整个家族影响较大[6]。因此,HCM基因突变研究具有重要意义。到目前为止,已经至少在27个基因突变中发现了1 600多个突变位点[7-8]。β-肌球蛋白重链(MYH7)基因是引起HCM的常见突变基因之一[9]。MYH7基因突变导致HCM的机制可能是因为心室肌能量供应不足,从而引起心室肌或室间隔肥厚而致病[10-13]。HCM的致病突变方式分为家族性和散发性两种。家族性HCM发病比较集中且呈家族聚集性,因此较好排查死亡的原因[14-15]。散发性HCM约占HCM的45%,因发病个体随机,死因确定较困难,是法医学的研究热点[16]。本研究对18例散发性HCM病人心肌MYH7基因的常见突变外显子进行测序分析,筛查基因突变位点,从而为HCM的预防、精准治疗及法医明确死亡原因、确定死者身份提供理论依据。
1 对象与方法 1.1 研究对象查阅青岛大学附属医院病理科、青岛市尸检中心、青岛市公安局刑警支队技术处2006年1月—2017年12月的尸检存档资料,以法医病理诊断为HCM(非高血压性)的猝死病人18例为本研究病例组的研究对象。HCM的病理诊断标准:①心脏质量增加1~2倍,成人平均心脏质量>500 g;②室间隔显著增厚,室间隔与左心室壁厚度比值>0.95,此为诊断HCM的主要指征;③组织学改变主要表现为心肌纤维显著肥大,排列紊乱呈漩涡状或簇状,细胞核大、深染,核形不一,可呈多形性畸形;心肌间质内小血管壁增厚,管腔狭窄;心肌间质常有局灶性胶原纤维增生及纤维化改变。对照组20例为因暴力死亡的尸体解剖病例,已排除心脏肥大和心脏结构性病变。本研究获得青岛大学附属医院伦理道德委员会的批准。
1.2 尸体解剖所有研究对象均经系统尸体解剖检查,并取心、肝、脾、肾、肺、脑等主要器官进行组织病理学检查。
1.3 基因组DNA提取用石蜡切片机(LEICA RM2235)切取研究对象的甲醛固定石蜡包埋组织,利用石蜡包埋组织DNA提取试剂盒(TIANGEN,离心柱型)提取心脏标本基因组DNA。
1.4 聚合酶链反应(PCR)及产物克隆根据NCBI GenBank中的MYH7基因序列,应用Primer blast引物设计软件并根据含侧翼内含子序列进行相应外显子引物设计(表 1)。设计的引物由上海生物工程公司合成。所用PCR扩增试剂为Premix TaqTM(EX TaqTM Version 2.0)。PCR反应体系25 μL,其内含有DNA模板2.0 μL,Premix 12.5 μL,上、下游引物各3 μmol/L,灭菌水4.5 μL。PCR扩增条件:98 ℃、10 s,55~62 ℃、30 s,72 ℃、1 min,循环35次。扩增产物由上海生物工程公司进行克隆测序。
| 表 1 MYH 7基因目标外显子扩增引物序列及其扩增片段长度 |
|
|
运用Chromas程序,根据NCBI、UCSC提供的正常人MYH7基因的基因组序列来分析测序结果,确定突变位点。利用Blast在线数据库进行突变位点物种间同源性比对,分析物种间保守性。
2 结果 2.1 法医病理学检查本文18例散发性HCM猝死者中,男10例,女8例;年龄15~49岁,平均35岁。病例组心脏标本尸检特点均符合HCM诊断标准。其中1例心脏质量630 g,室间隔厚度/左心室壁厚度为1.38;1例心脏质量494 g,室间隔厚度/左心室壁厚度为1.35。光镜下这2例心肌组织切片苏木精-伊红染色主要表现为细胞核大、深染,细胞核形状不一,可见多形性畸形,心肌纤维显著肥大,排列紊乱呈漩涡状或簇状;Masson染色可见心肌间质局灶性胶原纤维增生及心肌纤维化改变(图 1)。结合2例死者突然猝死的临床表现,按照HCM的法医病理学诊断标准,从组织病理学水平明确是由HCM导致的SCD。对照组心脏标本大体观察及组织学检查均未见异常。
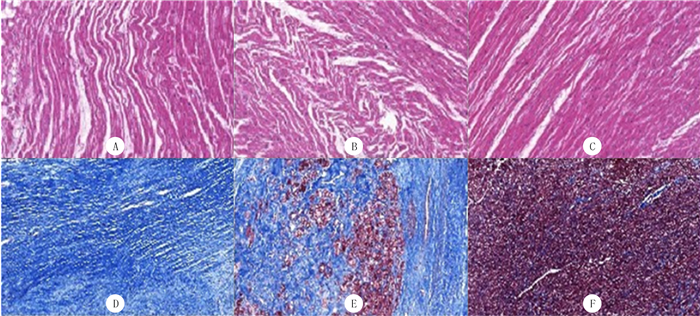 |
| A:Thr446Pro突变心肌组织苏木精-伊红染色;B:Phe468Leu突变心肌组织苏木精-伊红染色;C:正常心肌组织苏木精-伊红染色;D:Thr446Pro突变心肌组织Masson染色;E:Phe468Leu突变心肌组织Masson染色;F:正常心肌组织Masson染色。200倍。 图 1 MYH7基因突变及正常对照组织病理观察 |
在18例无血缘关系的中国汉族散发性HCM猝死者中,其中1例发现NM_000257.2:c. 1336T>G (Thr446Pro)突变(rs796553039),即人类MYH7基因组第1336位碱基由T转换成G,使遗传密码由TGG转变成GGG,从而使其编码的第446位苏氨酸(Thr)转变为脯氨酸(Pro)(图 2A);1例发现有NM_000257.2:c.1402T>C(Phe468Leu)突变(rs727504338),即人类MYH7基因组第1402位碱基由T转换成C,使遗传密码由TTC转变成CTC,从而使其编码的第468位苯丙氨酸(Phe)转变为亮氨酸(Leu)(图 2B)。上述两个突变均位于MYH7基因的球状头部。对照组病例均未发现MYH7基因突变。运用BLAST在线数据库对人、牛、猩猩、鼠、兔、狗、猫、猪的MYH7氨基酸序列进行物种间保守性分析,结果显示Thr446和Phe468两个氨基酸残基在物种间均高度保守。
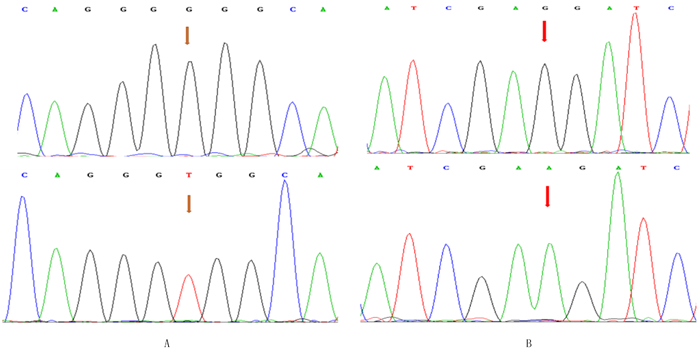 |
| A:本例Thr446Pro突变是第1336位碱基由T转变为G,导致氨基酸由Thr变成Pro;B:本例Phe468Leu突变是第1402位碱基由T转变为C,导致氨基酸由Phe变成Leu。上图为突变型,箭头所示为突变位点;下图为野生型,箭头所示为正常位点。 图 2 MYH7基因Thr446Pro突变和Phe468Leu突变测序图 |
本研究对MYH7基因的3、8、14、16~20、22、23、26、27号外显子进行检测,共发现2例散发性HCM猝死者含有MYH7基因错义突变位点,筛查到的Thr446Pro突变和Phe468Leu突变均为在国内首次发现的突变,且在ESP、OMIM、UCSC以及NCBI数据库中均未发现此两种核苷酸改变的报道。物种间保守性分析显示,Thr446和Phe468两个氨基酸残基在不同物种间高度保守,其表达的蛋白质结构和功能发生缺陷,提示一旦发生突变将对生命活动产生重要影响。而在对照组病例中均未发现这两种突变。
检测出错义突变的2例尸检病例,其大体观察可见心脏肥大,室间隔增厚、变硬,室间隔与左心室壁的厚度比值远大于0.95,苏木精-伊红染色可见细胞核大深染、呈多形性,Masson染色可见心肌间质局灶性胶原纤维增生及心肌纤维化改变。心肌纤维化又称为心肌钙化,是指正常的心肌组织结构中胶原蛋白浓度明显升高,出现胶原纤维的过量积聚或者胶原成分发生明显改变。高血压所致心肌肥厚的心肌纤维化程度远低于HCM病人的心肌纤维化程度,故心肌纤维化改变是HCM病人典型的原发性病理学改变[17]。心肌细胞为不可再生细胞,一旦发生纤维组织增生,室间隔就会增厚、变硬,使心室充盈受限和舒张容量下降,导致心脏供血功能障碍,最终导致猝死的发生。
MYH7基因是第一个被确定为引起HCM的致病基因,也是HCM最常见的致病基因之一[18-20]。编码MYH7基因外显子全长5 808 bp,位于染色体14q12,共含有40个外显子,其中头部由第3~21号外显子形成,颈部由第21~25号外显子形成(又称为头-杆接合部),第25~40号外显子则形成杆部。MYH7基因发生突变具有聚集性,好发于头部及头-杆接合部,其他部位突变发现较少[21-23]。
本研究发现的Thr446Pro和Phe468Leu错义突变均发生于第14号外显子,位于MYH7基因的球状头部。WALSH等[23]的研究总结了MYH7突变导致HCM的相关文献报道,结果显示,MYH7突变中有229种为错义突变,占突变总数(238种)的96%;大部分致病基因突变发生在MYH7基因的球状头部与颈部,头部和颈部发生的突变所致的相关疾病表型较杆部区域突变更加严重,这些突变集中在第5~8、13~16和19~23号外显子,编码肌球蛋白发挥功能的关键区域、肌动蛋白结合位点、肌球蛋白重链与轻链结合位点、核苷酸连接位点及两个活性半胱氨酸连接区,突变后外显率和猝死率均较高[24]。其中,第14号外显子编码的MYH7两个半胱氨酸的连接区域,是球状头部的重要功能区。发生在此区域的突变还有Arg453Cys、Gly425Arg和Thr441Met,其临床外显率较高[25-27],推测其致病机制可能是该区域发生的突变可使肌球蛋白S1区的ATP酶活性增强,阻碍了肌球蛋白构象的改变或者使其与肌动蛋白及其他分子之间的相互作用发生了改变,最终导致HCM的发生,表现为高外显率、进展快、易致心力衰竭等恶性临床表现[23]。结合上述研究,我们认为本实验发现的两个突变位点造成氨基酸的改变不是单核苷酸多态性,而是HCM的致病突变。
HCM的临床诊断是基于对心脏肥大的检测,它既不特异也不敏感,DNA测序技术的出现则为HCM的诊断提供了新的方向,特别是在早期诊断和独立的临床表型方面[20, 28]。基因筛查中仅有一半的概率能够检测到突变基因,这表明仍然有很多与HCM相关的突变基因未被识别。先证者有时可能携带两个致病的突变,但基因筛查仅筛查出其中一个,或者基因突变是从头突变,这样会影响到基因检测的结果。因此,需要进行大样本的基因检测与临床表型分析,为HCM防治策略的制定提供充分的依据[29]。
在法医学中,大部分SCD案例通过尸体解剖、组织病理学检查可以明确死因为心源性疾病,尚有少数案例虽经详细检验并高度怀疑为SCD,但仍不能明确死因是心脏疾病。随着现代分子生物学技术的发展,发现此类猝死者中有相当一部分为HCM所致,因此,研究HCM基因突变位点,可以为法医学实践中SCD原因的鉴定提供指导。本研究发现的MYH7基因Thr446Pro和Phe468Leu突变是国内最早发现的,可以引起HCM。散发性HCM也应警惕其将突变传递给下一代的风险,因此对散发性HCM病人进行家系排查同样具有重要意义。基因检测有助于HCM的诊断,不仅能为法医学明确死亡原因,还能提高猝死的防治水平。
| [1] |
阚通, 秦永文. 肥厚型心肌病[J]. 心血管病学进展, 2017, 38(3): 265-267. |
| [2] |
MARIAN A. Recent advances in genetics and treatment of hypertrophic cardiomyopathy[J]. Future Cardiology, 2005, 1(3): 341-353. DOI:10.1517/14796678.1.3.341 |
| [3] |
SAOUR B, SMITH B, YANCY C W. Heart failure and sudden cardiac death[J]. Card Electrophysiol Clin, 2017, 9(4): 709-723. DOI:10.1016/j.ccep.2017.07.010 |
| [4] |
SHAH L L, DAACK-HIRSCH S. Family communication about genetic risk of hereditary cardiomyopathies and arrhythmias: an integrative review[J]. Journal of Genetic Counseling, 2018, 27(5): 1022-1039. DOI:10.1007/s10897-018-0225-9 |
| [5] |
郑小菊, 王东, 宋莹, 等. β肌球蛋白重链基因Asn391Thr突变导致家族性肥厚型心肌病的基因型与临床表型分析[J]. 中国分子心脏病学杂志, 2014, 14(2): 899-902. |
| [6] |
李占全, 石蕴琦. 肥厚型心肌病新理念[J]. 中国循环杂志, 2017, 32(z2): 145-148. |
| [7] |
WANG Bo, GUO Ruiqi, WANG Jing, et al. The cumulative effects of the MYH7-V878A and CACNA1C-A1594V mutations in a Chinese family with hypertrophic cardiomyopathy[J]. Cardiology, 2017, 138(4): 228-237. DOI:10.1159/000478900 |
| [8] |
MARON B J, MARON M S, SEMSARIAN C. Genetics of hypertrophic cardiomyopathy after 20 years:clinical perspectives[J]. J Am Coll Cardiol, 2012, 60(8): 705-715. DOI:10.1016/j.jacc.2012.02.068 |
| [9] |
ZHAO Peng, CUI Hongli, HE Tingting, et al. Familial hypertrophic cardiomyopathy caused by a de novo Gly716Arg mutation of the beta-myosin heavy chain[J]. Cardiology in the Young, 2017, 27(3): 467-472. DOI:10.1017/S1047951116000731 |
| [10] |
JARCHO J A, MCKENNA W, PARE J A, et al. Mapping a gene for familial hypertrophic cardiomyopathy to chromosome 14q1[J]. New England Journal of Medicine, 1989, 321(20): 1372-1378. DOI:10.1056/NEJM198911163212005 |
| [11] |
GEISTERFER-LOWRANCE A A, KASS S, TANIGAWA G, et al. A molecular basis for familial hypertrophic cardio-myopathy: a beta cardiac myosin heavy chain gene missense mutation[J]. Cell, 1990, 62(5): 999-1006. DOI:10.1016/0092-8674(90)90274-I |
| [12] |
ROSENZWEIG A, WATKINS H, HWANG D S, et al. Preclinical diagnosis of familial hypertrophic cardiomyopathy by genetic analysis of blood lymphocytes[J]. New England Journal of Medicine, 1991, 325(25): 1753-1760. DOI:10.1056/NEJM199112193252501 |
| [13] |
WATKINS H, ROSENZWEIG A, HWANG D S, et al. Cha-racteristics and prognostic implications of myosin missense mutations in familial hypertrophic cardiomyopathy[J]. New England Journal of Medicine, 1992, 326(17): 1108-1114. DOI:10.1056/NEJM199204233261703 |
| [14] |
MARIAN A J, ROBERTS R. Recent advances in the molecular genetics of hypertrophic cardiomyopathy[J]. Circulation, 1995, 92(5): 1336-1347. DOI:10.1161/01.CIR.92.5.1336 |
| [15] |
SEIDMAN C E, SEIDMAN J G. Molecular genetic studies of familial hypertrophic cardiomyopathy[J]. Basic Research in Cardiology, 1998, 93(Suppl 3): 13-16. |
| [16] |
ERDMANN J, DAEHMLOW S, WISCHKE S, et al. Mutation spectrum in a large cohort of unrelated consecutive patients with hypertrophic cardiomyopathy[J]. Clinical Genetics, 2003, 64(4): 339-349. DOI:10.1034/j.1399-0004.2003.00151.x |
| [17] |
HUGHES S E. The pathology of hypertrophic cardiomyopathy[J]. Histopathology, 2004, 44(5): 412-427. DOI:10.1111/j.1365-2559.2004.01835.x |
| [18] |
ARAD M, SEIDMAN J G, SEIDMAN C E. Phenotypic diversity in hypertrophic cardiomyopathy[J]. Hum Mol Genet, 2002, 11(20): 2499-2506. DOI:10.1093/hmg/11.20.2499 |
| [19] |
RICHARD P, CHARRON P, CARRIER L, et al. Hypertrophic cardiomyopathy:distribution of disease genes, spectrum of mutations, and implications for a molecular diagnosis strategy[J]. Circulation, 2003, 107(17): 2227-2232. DOI:10.1161/01.CIR.0000066323.15244.54 |
| [20] |
NIIMURA H, BACHINSKI L L, SANGWATANAROJ S, et al. Mutations in the gene for cardiac myosin-binding protein C and late-onset familial hypertrophic cardiomyopathy[J]. N Engl J Med, 1998, 338(18): 1248-1257. DOI:10.1056/NEJM199804303381802 |
| [21] |
EPSTEIN N D, COHN G M, CYRAN F, et al. Differences in clinical expression of hypertrophic cardiomyopathy associated with two distinct mutations in the beta-myosin heavy chain gene. A 908leu-val mutation and a 403arg-gln mutation[J]. Circulation, 1992, 86(2): 345-352. DOI:10.1161/01.CIR.86.2.345 |
| [22] |
OLDFORS A. Hereditary myosin myopathies[J]. Neuromuscular Disorders:NMD, 2007, 17(5): 355-367. DOI:10.1016/j.nmd.2007.02.008 |
| [23] |
WALSH R, RUTLAND C, THOMAS R, et al. Cardiomyo-pathy:a systematic review of disease-causing mutations in myosin heavy chain 7 and their phenotypic manifestations[J]. Cardiology, 2010, 115(1): 49-60. DOI:10.1159/000252808 |
| [24] |
FANANAPAZIR L. Advances in molecular genetics and ma-nagement of hypertrophic cardiomyopathy[J]. JAMA:the Journal of the American Medical Association, 1999, 281(18): 1746-1752. DOI:10.1001/jama.281.18.1746 |
| [25] |
杨尹鉴, 樊朝美. 肥厚型心肌病基因突变检测的临床与社会意义[J]. 中华心血管病杂志, 2013, 41(8): 716-718. DOI:10.3760/cma.j.issn.0253-3758.2013.08.019 |
| [26] |
王虎, 邹玉宝, 宋雷, 等. 心脏肌球蛋白重链基因c.1273G > A突变与肥厚型心肌病的关联分析[J]. 遗传, 2009, 31(5): 485-488. DOI:10.3760/cma.j.issn.1003-9406.2009.05.001 |
| [27] |
冯秀丽, 范新萍, 杨忠伟, 等. 家族性肥厚型心肌病MYH7基因突变的筛查与分析[J]. 中华心血管病杂志, 2011, 39(2): 110-113. |
| [28] |
NIIMURA H, PATTON K K, MCKENNA W J, et al. Sarcomere protein gene mutations in hypertrophic cardiomyopathy of the elderly[J]. Circulation, 2002, 105(4): 446-451. DOI:10.1161/hc0402.102990 |
| [29] |
何亭亭, 赵鹏. 肥厚型心肌病的分子诊断和治疗[J]. 齐鲁医学杂志, 2016, 31(5): 625-627. |
 2019, Vol. 55
2019, Vol. 55

