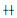2. 青岛市市立医院皮肤科
肝癌是世界上最常见的恶性肿瘤之一,也是导致癌症死亡的主要原因之一, 对人类健康和生命构成极大威胁[1-2]。据全球癌症数据调查显示,中国肝癌病人数约占全球的50%[3-4],肝细胞癌占原发性肝癌的70%~90%[5]。目前,肝癌治疗的方法主要为手术切除、放疗、化疗以及几种治疗方法的联合治疗[6-7]。手术切除不彻底、复发率高和转移率高等是影响肝癌治疗效果的主要问题[8-9]。因此,从分子水平上发展分子靶向药物及免疫治疗药物,可以大大提高肝癌病人的治疗效果[10-11]。核酸适配体是一类具有特定结构的单链DNA或RNA,其长度一般为20~80个碱基[12-13]。利用指数富集的配基系统进化(SELEX)技术,可以从随机单链核酸序列库中筛选出与靶标特异性结合的核酸适配体[14],而Cell-SELEX是在SELEX基础上发展而来,以细胞为靶标筛选获得核酸适配体的技术[15]。核酸适配体与抗体作用相似,但又优于抗体[16]。高特异性、高亲和力的适配体具有靶分子范围广、性质稳定、制备方便、无免疫原性、成本低、便于保存运输、易在体外化学合成等优点[17-19],为恶性肿瘤的早期诊断和治疗、肿瘤标志物的筛选提供了一种全新有效的方法和手段[20]。目前,以肝癌细胞为靶标进行的适配体筛选均是以单一的某一种肝癌细胞为靶标,尚未见以两种或多种细胞为靶标进行的适配体筛选的报道。本研究以HepG2、SMMC-7721两种肝癌细胞作为混合靶标,应用Cell-SELEX技术筛选特异性核酸适配体,期望获得能靶向两种肝癌细胞的核酸适配体,从而建立获得广泛靶向肝癌细胞靶标的方法。同时,本文自适配体筛选第4轮结束后引入人源永生化正常肝细胞系L-02进行消减筛选,排除适配体对正常细胞的影响,为后期通过适配体载药进行肝癌的基因治疗时,更有效地减小毒副作用、提高肿瘤部位的局部药物浓度奠定基础。
1 材料与方法 1.1 实验材料 1.1.1 细胞筛选靶细胞采用人源肝癌细胞系HepG2、SMMC-7721(青岛大学附属医院中心实验室提供); 消减筛选细胞为人源永生化正常肝细胞系L-02(购自中国科学院上海细胞库); 特异性检测细胞包括人源永生化乳腺细胞系HBL100、人源乳癌细胞MCF-7、人源大细胞性肺癌细胞H460、人结直肠腺癌细胞SW480及人源胃癌细胞MGC-803(青岛大学附属医院中心实验室提供)。以上细胞均采用含体积分数0.10胎牛血清(美国Gibco公司)的高糖DMEM培养基(美国Hyclone公司)培养。
1.1.2 文库及引物初始文库Gp30,由两端的固定序列和中间30个nt的随机序列组成,其中Pstemloop-tgatt划线部分序列可形成发卡结构,与Plong-1 tgtc引物在PCR过程中阻止正链延伸,可产生不等长PCR产物[21],从而制备单链次级文库投入下一轮筛选。Plong-1 tgtc与P11-tgatt用于扩增双链产物,便于富集文库克隆至pGM-T质粒载体测序获得单克隆序列。见表 1。以上文库、引物及FAM标记适配体序列均由生工生物工程(上海)股份有限公司合成、修饰。
| 表 1 PCR引物及其序列 |
|
|
ssDNA文库(原始文库或次级文库)100 ℃变性5 min,立即冰浴10 min。加入筛选缓冲液各组分,最终孵育体系内含有:1× PBS、1 mmol/L浓度MgCl2、0.1 g/L的酵母tRNA、0.1 g/L鲑鱼精DNA和所需要的ssDNA文库。将预先处理好的ssDNA文库加入接种于96孔板的靶细胞(HepG2或SMMC-7721,每隔两轮更换靶细胞,两种靶细胞交替使用),4 ℃孵育30 min;吸弃上清,筛选洗涤缓冲液(1×PBS,1 mmol/L MgCl2)轻柔洗涤3~4次;加入洗脱液(100 ℃双蒸水),对结合在靶细胞上的ssDNA进行洗脱;以洗脱液作为模板,利用Plong-1 tgtc和Pstemloop-tgatt进行不等长PCR扩增。完成4轮筛选之后,从第5轮引入消减筛选,在与靶细胞进行筛选之前将孵育体系与消减细胞L-02在4 ℃孵育20 min,除去与L-02结合的适配体,将其余未结合的文库与靶细胞孵育,进行第5轮筛选。
1.2.2 PCR扩增条件优化PCR体系100 μL,内含:10×PCR反应缓冲液10 μL,dNTP混合物(每种核苷酸2.5 mmol/L)8 μL,Plong-1(25 μmol/L)1 μL,Pstemloop-3(25 μmol/L)1 μL,Taq DNA聚合酶(2.5×106 U/L)1 μL。加入2~3 μL洗脱液作为模板,为获得双链不等长的产物,采用茎环引物;为防止延伸阶段茎环打开,设置PCR反应条件为:94 ℃、30 s,45 ℃、30 s,58 ℃、30 s。自12个循环数开始至40个循环结束,每隔3个循环取10 μL产物,应用含7 mol/L尿素的聚丙烯酰胺凝胶进行电泳,选取非特异性扩增少、产物量刚达到平台期的循环数作为大量扩增的条件。
1.2.3 ssDNA次级文库的制备应用含7 mol/L尿素的聚丙烯酰胺凝胶进行电泳,然后将正确大小的ssDNA条带切胶,置于1.5 mL的EP管中。每管加入400 μL的凝胶洗脱液(其内含有0.5 mol/L NH4AC,2 g/L SDS,1 mmol/L EDTA),37 ℃摇床上洗脱6 h以上。将凝胶洗脱液转移到新管,加入1 mol/L MgCl2 4 μL、3 mol/L醋酸钠(pH值5.2)40 μL和预冷的无水乙醇1 mL,混匀,于-70 ℃沉淀过夜。4 ℃、12 000 r/min离心30 min,弃上清;用预冷的体积分数0.75乙醇1 mL洗涤,4 ℃、12 000 r/min离心30 min;弃上清,自然晾干。双蒸水逐管润洗回收ssDNA(回收的ssDNA使用NanoDrop进行质量鉴定后投入次轮筛选)。
1.2.4 克隆与测序将经过10轮筛选的适配体文库扩增为双链后连接T载体,转化至感受态E.coil DH5α中,随机挑取60个适配体进行克隆测序。运用RNA structure软件进行二级结构绘图并且通过MEME在线软件(http://meme.sdsc.edu/meme/cgi-bin/meme.cgi)进行结构同源性分析。选择具有代表性的序列并进行FAM标记,与靶标孵育后通过流式细胞术鉴定序列对靶标进行识别,最终筛选获得适配体序列。
1.2.5 流式细胞术鉴定富集文库将肝癌细胞HepG2用DMEM洗去死细胞,胰酶消化,离心,筛选洗涤缓冲液重悬,然后分别与用FAM标记的引物Plong-1 tgtc扩增获得FAM标记的第6轮、8轮、10轮文库,4 ℃避光孵育10 min,离心后加入200 μL筛选洗涤缓冲液重悬。流式细胞仪检测不同轮数文库中可以结合靶标的适配体富集程度。
1.2.6 适配体10-8与筛选细胞结合鉴定应用流式细胞术验证获得的适配体与筛选细胞(靶细胞与消减细胞)的结合情况。同时以FAM标记的原适配体库Gp30作为对照,分别比较获得的适配体、Gp30与不同细胞结合的荧光强度。
1.2.7 获得的适配体的特异性检验核酸适配体对靶标的特异性识别能力是其作为特异性分子识别探针的关键,因此本文检测了获得的适配体分别与多种不同细胞的结合情况。获得的适配体分别与多种不同细胞系(人源永生化乳腺细胞系HBL100、人源乳癌细胞MCF-7、人源大细胞性肺癌细胞H460、人源胃癌细胞MGC-803、人源肠腺癌细胞SW480)孵育后,用流式细胞术检测结合情况。同时用非靶细胞的人源肝癌细胞HCC-LM3进行特异性鉴定。
2 结果 2.1 文库富集程度为鉴定文库富集情况,利用FAM标记引物扩增、回收得到FAM标记的第6轮、8轮、10轮次级文库。以FAM标记的原适配体文库Gp30作为对照,分别与HepG2孵育,通过流式细胞术检测第6轮、8轮、10轮次级文库与靶细胞的结合。结果显示,与原适配体文库Gp30相比,第6轮、8轮、10轮次级文库峰值右移,荧光强度增强,显示筛选至第6轮文库已有一定程度富集,第10轮文库得到进一步富集(图 1)。
 |
| 图 1 流式细胞术鉴定文库的富集 |
利用Cell-SELEX筛选最终获得适配体序列10-8,运用RNA Structure 4.6软件预测得到的其二级结构见图 2。
 |
| 图 2 适配体10-8二级结构 |
流式细胞术结果显示,适配体10-8与肝癌细胞HepG2、SMMC-7721结合的荧光强度明显比原适配体文库Gp30强,波峰右移。人源永生化正常肝细胞系L-02细胞与适配体10-8及原适配体文库Gp30结合的荧光强度拟合曲线中,适配体10-8与原适配体文库的荧光强度接近,波峰重叠,没有明显差异(图 3)。
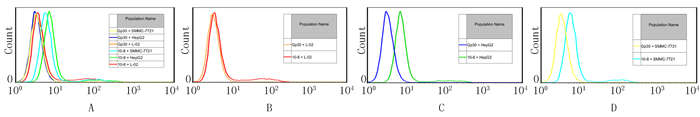 |
| A:原适配体文库Gp30和适配体10-8与细胞HepG2、SMMC7721、L-02结合情况;B:原适配体文库Gp30和适配体10-8与L-02结合情况;C:原适配体文库Gp30和适配体10-8与HepG2结合情况;D:原适配体文库Gp30和适配体10-8与SMMC7721结合情况。 图 3 适配体10-8与HepG2、SMMC7721、L-02的结合 |
以细胞与核酸适配体孵育后产生的荧光超出阈值的百分比判断核酸适配体与细胞的作用。结果显示,与靶标人源肝癌细胞系HepG2、SMMC-7721相比,适配体10-8与其他肿瘤细胞孵育后不结合,与非靶标细胞的人源肝癌细胞HCC-LM3弱结合,表明筛选所得适配体10-8具有高特异性。见表 2。
| 表 2 适配体10-8与不同细胞的结合情况 |
|
|
肝癌的早期诊断和精准治疗对提高病人生存率具有重要意义,通过分子生物学的方法寻找特异识别肝癌细胞的适配体对于肝癌的早期诊断和靶向治疗至关重要。以往的靶向肝癌细胞的适配体筛选都是以单一的某一种肝癌细胞为靶细胞[22-24],本研究期望获得能够普遍靶向多种肝癌细胞的适配体,以HepG2、SMMC-7721两种肝癌细胞作为混合靶细胞。HepG2细胞是经典的、国际上公认的肝癌细胞[25],但裸鼠成瘤性稍差[26];SMMC-7721细胞为国内建系细胞,成瘤性稍强[27-28]。从创新性和后期实用性的角度出发,本课题组应用Cell-SELEX技术首次以HepG2和SMMC-7721两种肝癌细胞为混合靶标进行特异性筛选,并以永生化的人源正常肝细胞系L-02细胞进行消减筛选。
Cell-SELEX是在未知靶物质的情况下,筛选出特异性识别细胞的适配体。本文研究以HepG2、SMMC-7721两种肝癌细胞每隔两轮交替作为靶细胞筛选特异性适配体,经过10轮筛选得到富集文库,经过克隆、测序得到60条单一适配体序列,运用RNA Structure软件进行二级结构预测并且通过MEME软件进行结构同源性分析,适配体序列的二级结构以茎环结构为主,且不同序列的茎环数目存在较大差异,茎环位置及大小也各不同,推测这样的结构是适配体与靶标结合的结构基础[29-30]。从测序的60条单一序列中选择10条具有代表性的序列进行FAM标记,通过流式细胞术进行结合鉴定。同时,为降低非特异性适配体,在第4轮后引入消减细胞人源正常肝细胞系L-02。此外,进行PCR反应条件优化对整个筛选过程至关重要,PCR扩增的循环数多会增加非特异性扩增。
本研究筛选获得一条适配体10-8,可以特异性识别HepG2和SMMC-7721两种人源肝癌细胞,且不与消减细胞L-02结合。此外,对适配体10-8进行种属特异性鉴定发现,该适配体不与人源永生化乳腺细胞系HBL100、人源乳癌细胞MCF-7、人源大细胞性肺癌细胞H460以及人源结肠腺癌细胞SW480特异性结合,与人源胃癌细胞MGC-803结合弱,说明该适配体具有良好的细胞种属特异性。将适配体10-8与另一种非靶细胞的人源肝癌细胞HCC-LM3进行结合鉴定发现,该适配体也可以特异性识别HCC-LM3细胞。
目前,尚未见以两种或多种细胞为靶标进行的适配体筛选的报道,本研究以两种肝癌细胞作为混合靶标,筛选获得特异性核酸适配体10-8。由此,我们认为适配体10-8可能是一种可特异性靶向肝癌的适配体,这对特异性检测肝癌细胞或治疗药物靶向投递具有参考价值。
| [1] |
LIN Meihua, LV Duo, ZHENG Yunliang, et al. Downregulation of CPT2 promotes tumorigenesis and chemoresistance to cisplatin in hepatocellular carcinoma[J]. Onco Targets and Therapy, 2018, 11: 3101-3110. DOI:10.2147/OTT.S163266 |
| [2] |
XIE Youhua. Hepatitis B virus-associated hepatocellular carcinoma[J]. Adv Exp Med Biol, 2017, 1018: 11-21. |
| [3] |
TORRE L A, BRAY F, SIEGEL R L, et al. Global cancer statistics, 2012[J]. CA-A Cancer Journal for Clinicians, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [4] |
ZHANG Keming, SONG Peipei, GAO Jianjun, et al. Perspectives on a combined test of multi serum biomarkers in China: towards screening for and diagnosing hepatocellular carcinoma at an earlier stage[J]. Drug Discoveries & Therapeutics, 2014, 8(3): 102-109. |
| [5] |
TORRE L A, SIEGEL R L, WARD E M, et al. Global cancer incidence and mortality rates and trends-An update[J]. Can-cer Epidemiology, Biomarkers & Prevention: a Publication of the American Association for Cancer Research, Cosponsored by the American Society of Preventive Oncology, 2016, 25(1): 16-27. |
| [6] |
AERTS M, BENTEYN D, VAN VLIERBERGHE H A, et al. Current status and perspectives of immune-based therapies for hepatocellular carcinoma[J]. World Journal of Gastroente-rology, 2016, 22(1): 253-261. DOI:10.3748/wjg.v22.i1.253 |
| [7] |
DALTON-FITZGERALD E, TIRO J, KANDUNOORI P A, et al. Practice patterns and attitudes of primary care providers and barriers to surveillance of hepatocellular carcinoma in patients with cirrhosis[J]. Clinical Gastroenterology and Hepatology, 2015, 13(4): 791. DOI:10.1016/j.cgh.2014.06.031 |
| [8] |
MATSUDA T, SAIKA K. Trends in liver cancer mortality rates in Japan, USA, UK, France and Korea based on the WHO mortality database[J]. Japanese Journal of Clinical Oncology, 2012, 42(4): 360-361. DOI:10.1093/jjco/hys048 |
| [9] |
SINTRA S N, TOME L, CIPRIANO M A, et al. Long-term outcome of the first 150 liver transplant recipients: a single-center experience[J]. Transplantation Proceedings, 2013, 45(3): 1119-1121. DOI:10.1016/j.transproceed.2013.02.101 |
| [10] |
BRUIX J, GORES G J, MAZZAFERRO V. Hepatocellular carcinoma: clinical frontiers and perspectives[J]. Gut, 2014, 63(5): 844-855. DOI:10.1136/gutjnl-2013-306627 |
| [11] |
BRUIX J, HAN K H, GORES G, et al. Liver cancer: approaching a personalized care[J]. Journal of Hepatology, 2015, 62(1): S144-S156. DOI:10.1016/j.jhep.2015.02.007 |
| [12] |
SUN Hongguang, ZU Youli. A highlight of recent advances in aptamer technology and its application[J]. Molecules, 2015, 20(7): 11959-11980. DOI:10.3390/molecules200711959 |
| [13] |
ALSINA D, PURROY R, ROS J, et al. Iron in friedreich ataxia: a central role in the pathophysiology or an epiphenomenon?[J]. Pharmaceuticals, 2018, 11(3): 89. DOI:10.3390/ph11030089 |
| [14] |
李保玉, 刘家云, 屈园利, 等. SELEX技术筛选纤维蛋白适配子的研究[J]. 现代生物医学进展, 2015, 15(11): 2037-2041. |
| [15] |
堵玉林, 莫柳婷, 易娅莎, 等. 基于Cell-SELEX的核酸适配体在生化分析与生物成像中的应用[J]. 分析化学, 2017, 45(12): 253-282. |
| [16] |
JAYASENA S D. Aptamers: an emerging class of molecules that rival antibodies in diagnostics[J]. Clinical Chemistry, 1999, 45(9): 1628-1650. |
| [17] |
YAN A C, BELL K M, BREEDEN M M, et al. Aptamers: prospects in therapeutics and biomedicine[J]. Frontiers in Bioscience: a Journal and Virtual Library, 2005, 10(2): 1802-1827. |
| [18] |
WANG Lijun, WANG Ronghui, WEI Hua, et al. Selection of aptamers against pathogenic bacteria and their diagnostics application[J]. World Journal of Microbiology & Biotechnology, 2018, 34(10): 149-160. |
| [19] |
高国生, 刘兴晖. 指数级富集配体的系统进化技术筛选高转移肝癌细胞HCCLM3的ssDNA适配子[J]. 中国卫生检验杂志, 2017, 27(2): 160-162. |
| [20] |
FANG Xiaohong, TAN Weihong. Aptamers generated from cell-SELEX for molecular medicine: a chemical biology approach[J]. Accounts of Chemical Research, 2010, 43(1): 48-57. DOI:10.1021/ar900101s |
| [21] |
CAO Xiaoxiao, LI Shaohua, CHEN Liucun, et al. Combining use of a panel of ssDNA aptamers in the detection of Staphylococcus aureus[J]. Nucleic Acids Research, 2009, 37(14): 4621-4628. DOI:10.1093/nar/gkp489 |
| [22] |
CIVIT L, TAGHDISI S M, JONCZYK A, et al. Systematic evaluation of cell-SELEX enriched aptamers binding to breast cancer cells[J]. Biochimie, 2018, 145(145): 53-62. |
| [23] |
LIU Zhongbing, SUN Xiaoduan, XIAO Shuangli, et al. Cha-racterization of aptamer-mediated gene delivery system for li-ver cancer therapy[J]. Oncotarget, 2018, 9(6): 6830-6840. |
| [24] |
周文虎, 丁劲松. 核酸适配体在抗肿瘤药物主动靶向传递中的应用[J]. 中国医药工业杂志, 2012, 43(6): 490-496. DOI:10.3969/j.issn.1001-8255.2012.06.025 |
| [25] |
CHENG Ke, CHEN Zhi, LIU Lian, et al. ZNF667 serves as a putative oncogene in human hepatocellular carcinoma[J]. Cellular Physiology & Biochemistry, 2017, 41: 2523-2533. |
| [26] |
ZHANG Zhilei, LIU Guangchao, PENG Li, et al. Effect of PAK1 gene silencing on proliferation and apoptosis in hepatocellular carcinoma cell lines MHCC97-H and HepG2 and cells in xenograft tumor[J]. Gene Therapy, 2018, 25(4): 284-296. DOI:10.1038/s41434-018-0016-9 |
| [27] |
邵俊斌, 陈智. 肝癌细胞株中肿瘤特异性抗原MAGE、GAGE、BAGE基因表达的研究[J]. 中华肝脏病杂志, 2003, 11(3): 15-17. |
| [28] |
SUN Liang, LI Pibao, YAO Yanfen, et al. Proteinase-activated receptor 2 promotes tumor cell proliferation and metastasis by inducing epithelial-mesenchymal transition and predicts poor prognosis in hepatocellular carcinoma[J]. World Journal of Gastroenterology, 2018, 24(10): 1120-1133. DOI:10.3748/wjg.v24.i10.1120 |
| [29] |
JHAVERI S D, KIRBY R, CONRAD R, et al. Designed signaling aptamers that transduce molecular recognition to changes in fluorescence intensity[J]. Journal of the American Chemical Society, 2000, 122(11): 2469-2473. DOI:10.1021/ja992393b |
| [30] |
黄博, 彭磊, 王帅, 等. SELEX技术筛选变形链球菌UA159适配子可行性的研究[J]. 现代生物医学进展, 2012, 12(21): 4001-4005. |
 2019, Vol. 55
2019, Vol. 55