2. 青岛大学附属医院重症医学科;
3. 山东大学呼吸与危重症医学专业;
4. 中山大学临床医学系
ICU中的病人,往往因为自身疾病、气管插管、频繁有创操作带来的疼痛和不适,环境中的噪声、灯光刺激,昼夜不分、睡眠剥夺以及对自身命运的忧虑和对亲人的思念等原因而出现焦虑乃至躁动,使得人体长时间处于应激状态,导致一系列神经内分泌反应,加重各器官的负担。同时,躁动可能导致导管脱出等严重意外发生[1]。这些都可能会影响到病人的预后及生命安全。因此,良好的镇静镇痛治疗是ICU治疗中的重要一环。右美托咪定是一种高度选择性α2受体激动剂,通过抑制疼痛信号的传导和减少去甲肾上腺素的释放,起到镇静、镇痛、抗焦虑的作用。使用右美托咪定进行镇静的病人更容易被唤醒,呼吸抑制较少[2]。既往的许多研究及指南对右美托咪定的临床效果给予了肯定[3]。而近期一项研究结果显示,右美托咪定并没有改善病人的28 d无呼吸机天数和病死率[4]。因此,仍需对右美托咪定进行更多的研究。本研究对ICU机械通气病人应用右美托咪定与其他镇静药物疗效的差异进行了Meta分析,以期为ICU机械通气病人临床镇静药物的选择提供参考。
1 资料与方法 1.1 检索策略由两名研究者独立检索Pubmed、Embase、Cochrane Library、Web of Science、中国知网、万方数据库、维普期刊、中国生物医学文献数据库,并将检索结果进行合并,对于持不同意见的结果经双方讨论后达成一致。英文数据库检索关键词为Dexmedetomidine、Mechanical ventilation、RCT及其同义词。中文数据库检索关键词为右美托咪定、机械通气、随机对照试验及其同义词。检索时限为从建库至2018年7月。
1.2 文献纳入及排除标准文献纳入标准:①研究类型为随机对照试验(RCT);②研究对象为入住ICU的年龄≥18岁的机械通气病人,疾病种类和严重程度、种族、文化水平等不限,但不包括冠状动脉旁路移植术(CABG)术后病人;③研究分为右美托咪定组和对照组,右美托咪定组使用右美托咪定进行镇静,对照组使用其他镇静药物;④测量指标包括机械通气时间、ICU住院时间、谵妄发生率、低血压发生率、心动过缓发生率、28 d病死率。排除标准:研究类型为动物实验、病例报道、回顾性研究者。
1.3 文献筛选和数据提取整理检索到的文献,使用Endnote进行管理。由两名研究员依据纳入及排除标准独立筛选文献。并评价纳入文献质量,提取文献中数据。若两人存在分歧则先通过讨论解决,若仍无法达成一致则交由第三名研究员裁定。提取的资料包括文献题目、作者、发表时间、出处,研究对象基本信息,右美托咪定组及对照组所用药物,主要结局指标等。
1.4 文献质量评价按照Cochrane系统评价手册要求,采用RevMan 5.3软件对每一项纳入的研究进行偏倚风险评估。包括随机序列的产生是否正确,是否采取了分配隐藏,盲法的实施是否完善,观察数据是否完整,是否有选择性报道结果以及其他偏倚。
1.5 统计学分析应用RevMan 5.3软件进行统计学分析。采用Q检验分析数据的异质性,I2>50%的采用随机效应模型,I2≤50%的采用固定效应模型进行Meta分析。对于二分类资料,计算相对危险度(RR)或比值比(OR)及其95%可信区间(95%CI);对于连续性资料,计算均数差(MD)或标准化均数差(SMD)及其95% CI。以P<0.05为差异有显著性。
2 结果 2.1 纳入文献质量评价通过检索数据库初步得到文献1 226篇,排除重复发表的文献后剩余1 095篇。在阅读题目及摘要后排除了与课题无关的文献,剩余文献112篇。通过进一步阅读全文排除了基础研究、综述和回顾性研究,最终纳入文献24篇[4-27],其中英文文献19篇,中文文献5篇。共计4 316例病人,右美托咪定组2 165例,对照组2 151例。纳入的24项研究均采用计算机随机数字生成器或随机数字表法产生随机序列;16项研究采用了双盲法,2项研究采用了单盲法,4项研究未采用盲法,2项研究未明确提及施盲方法;所有文献均无明确的结果数据缺失和选择性报道(图 1)。纳入文献的发表偏倚较小(图 2)。
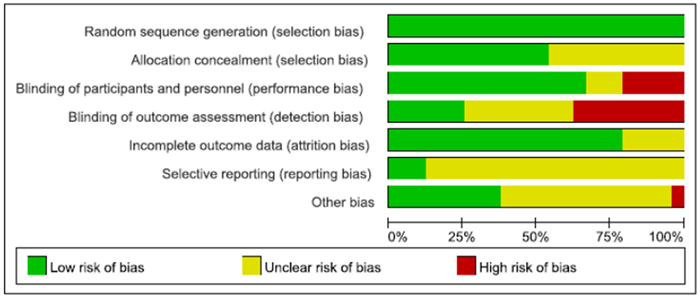 |
| 图 1 纳入研究偏倚风险评估 |
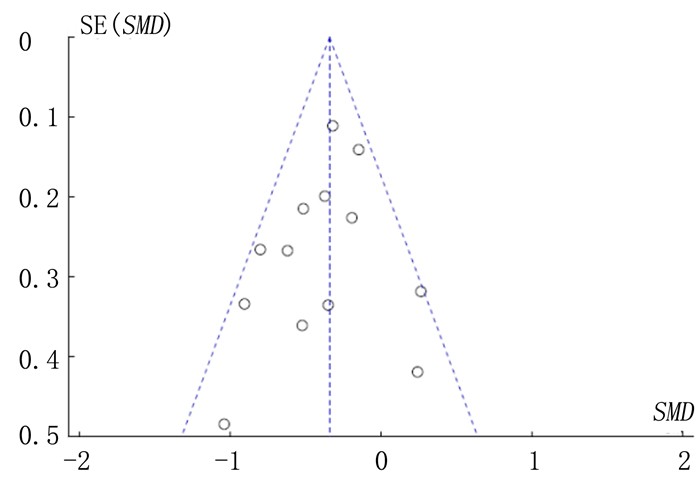 |
| 图 2 纳入研究发表偏倚风险评估 |
7项研究报道了右美托咪定对病人机械通气时间的影响。将中位数和四分位数数据转换为均数及标准差后对7项研究的数据进行Meta分析,结果显示,右美托咪定组的机械通气时间较对照组显著缩短(SMD=-0.20,95%CI=-0.33~-0.08,P<0.01)。见图 3。同时对4项长期镇静(镇静持续时间>24 h)以及1项短期镇静(镇静时间≤24 h)研究进行了亚组分析,结果显示,长期镇静亚组中右美托咪定组机械通气时间较对照组显著缩短(SMD=-0.15,95%CI=-0.29~-0.01,P<0.01),而短期镇静亚组中右美托咪定组的机械通气时间与对照组比较差异无统计学意义(P>0.05)。见图 4。
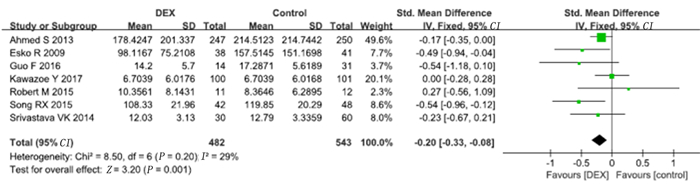 |
| 图 3 右美托咪定对机械通气时间影响的Meta分析 |
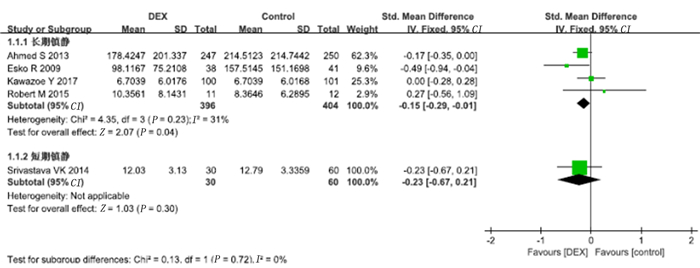 |
| 图 4 右美托咪定对机械通气时间影响的亚组分析 |
13项研究报道了ICU住院时间。将中位数和四分位数数据转换为均数及标准差后对13项研究的数据进行Meta分析,结果显示,右美托咪定组的ICU住院时间显著短于对照组(SMD=-0.35,95%CI=-0.47~-0.23,P<0.01)。见图 5。同时对符合长期镇静标准的5项研究进行了亚组分析(无符合标准的短期镇静研究),结果显示,右美托咪定组的ICU住院时间显著短于对照组(SMD=-0.25,95%CI=-0.40~-0.10,P<0.01)。见图 6。
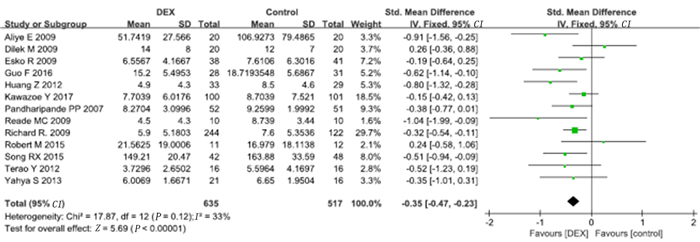 |
| 图 5 右美托咪定对ICU住院时间影响的Meta分析 |
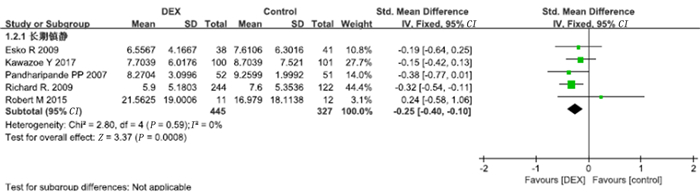 |
| 图 6 右美托咪定对ICU住院时间影响的亚组分析 |
10项研究报道了谵妄病例数。Meta分析显示,右美托咪定组的谵妄发生率显著低于对照组(OR=0.75,95%CI=0.66~0.84,P<0.01)。见图 7。同时对5项长期镇静及1项短期镇静研究进行了亚组分析,结果显示,长期镇静亚组中右美托咪定组谵妄发生率显著低于对照组(OR=0.56,95%CI=0.43~0.72,P<0.01),短期镇静亚组中右美托咪定组与对照组谵妄发生率比较差异无显著性(P>0.05)。见图 8。
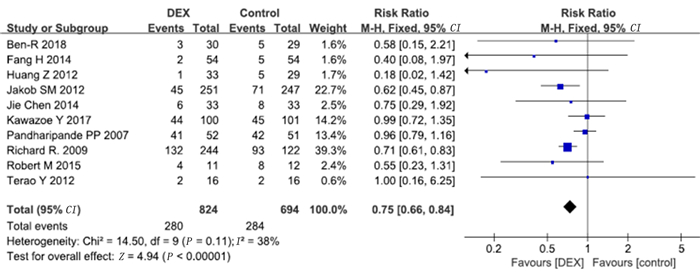 |
| 图 7 右美托咪定对谵妄发生率影响的Meta分析 |
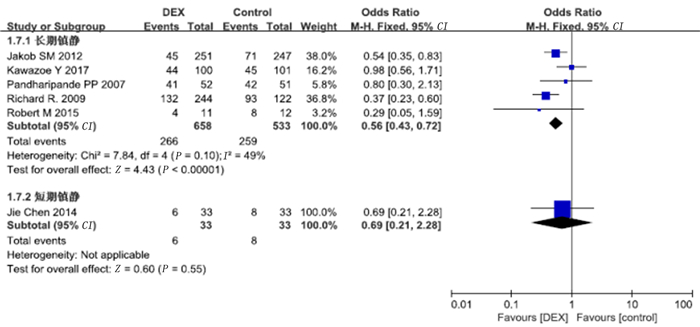 |
| 图 8 右美托咪定对谵妄发生率影响的亚组分析 |
有14项研究报道了心动过缓病例数,其中7项研究符合长期镇静的标准,2项研究符合短期镇静的标准。Meta分析的结果显示,右美托咪定组病人心动过缓发生率较对照组明显增加(RR=2.29,95%CI=1.87~2.79,P<0.01)。见图 9。长期镇静亚组中右美托咪定组的心动过缓发生率较对照组明显增加(RR=2.24,95%CI=1.74~2.88,P<0.01),短期镇静亚组中右美托咪定组病人心动过缓发生率也较对照组明显增加(RR=2.97,95%CI=1.59~5.55,P<0.01)。见图 10。
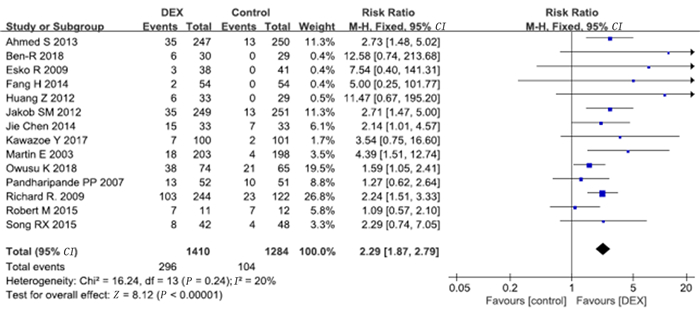 |
| 图 9 右美托咪定对心动过缓发生率影响的Meta分析 |
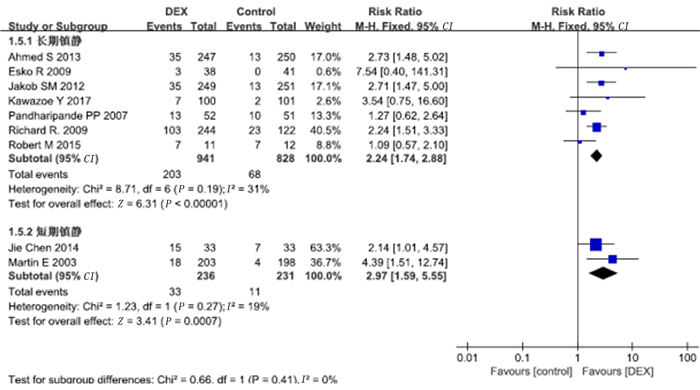 |
| 图 10 右美托咪定对心动过缓发生率影响的亚组分析 |
12项研究报道了低血压病例数。数据合并后发现存在较大异质性,检查后发现RICHARD的研究为异质性来源,对其进行敏感性检测后发现其不影响数据结果,剔除该组数据后将剩余数据再次合并,同时将符合标准的4项研究纳入长期镇静亚组,3项研究纳入短期镇静亚组。Meta分析显示,右美托咪定组的低血压发生率较对照组明显增加(RR=1.94,95%CI=1.54~2.44,P<0.01)。长期镇静亚组中右美托咪定组低血压发生率较对照组增加(RR=2.14,95%CI=1.57~2.91,P<0.01),短期镇静亚组中右美托咪定组低血压发生率也较对照组增加(RR=1.70,95%CI=1.13~2.55,P<0.01)。见图 11、12。
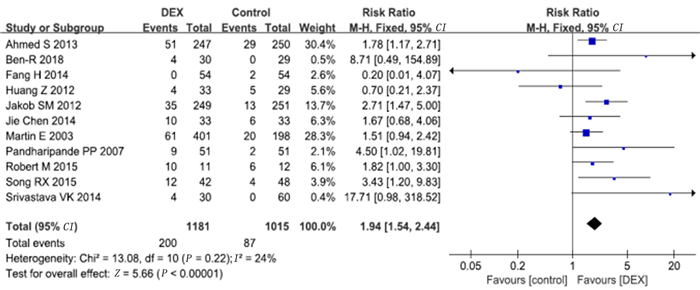 |
| 图 11 右美托咪定对低血压发生率影响的Meta分析 |
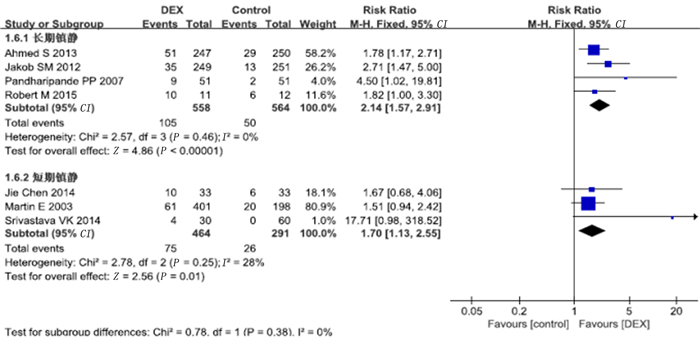 |
| 图 12 右美托咪定对低血压发生率影响的亚组分析 |
d病死率的影响6项研究报道了28 d死亡病例数,其中4项符合标准的研究纳入长期镇静亚组,无研究符合短期镇静标准。Meta分析显示,右美托咪定组的28 d病死率与对照组比较无明显改善(RR=0.84,95%CI=0.64~1.11,P>0.05)。长期镇静亚组中右美托咪定组病人28 d病死率与对照组相比较无改善(RR=0.91,95%CI=0.67~1.24,P>0.05)。见图 13、14。
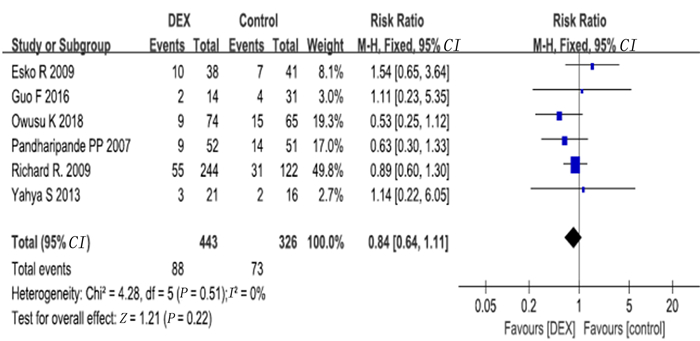 |
| 图 13 右美托咪定对28 d病死率影响的Meta分析 |
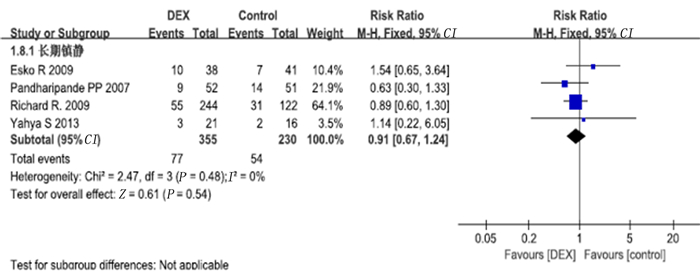 |
| 图 14 右美托咪定对28 d病死率影响的亚组分析 |
ICU的住院病人由于自身疾病、持续的声光刺激、使用镇静镇痛药物、频繁的翻身等原因会产生焦虑、躁动,从而使机体处于应激状态,损害机体的免疫和修复功能[28]。同时,ICU病人普遍存在着睡眠剥夺现象,而这与ICU病人谵妄的发生有显著相关性,进而显著增加病人病死率及ICU住院时间[29]。恰当的镇静镇痛治疗可以使病人处于安静舒适的状态,减轻机体的应激反应,保障病人的睡眠,达到预防谵妄、改善预后的目的[30]。
镇静的目标是使病人平静、合作,易于唤醒并可表达他们的需求[31],而右美托咪定可以很好地满足临床需要。右美托咪定是一种选择性α2受体激动剂,相对于苯胺咪唑啉而言具有更高的选择性,它通过作用于脑内蓝斑核、脊髓后角突触前及中间神经元突触后膜的α2受体抑制疼痛信号的传导,还可抑制去甲肾上腺素的释放,从而起到镇静、镇痛、抗焦虑的作用[32]。由于该药并不作用于中脑网状上行系统和GABA受体,引发的是自然非动眼睡眠状态(类似于生理睡眠二期的睡眠)[33-34],使得使用右美托咪定镇静的病人更容易被唤醒,呼吸抑制较少[2]。右美托咪定的药代动力学不受病人年龄、性别、种族或严重肾功能不全等因素的影响[35-37]。但也有研究结果表明,右美托咪定主要在肝脏中代谢,因此在肝功能损害的病人中应谨慎使用,并应考虑减少维持剂量[35]。总体来说,右美托咪定是一种效果良好、副作用较少、适用范围较广的镇静药物。大量的临床试验结果也表明,应用右美托咪定的病人处于目标镇静范围内的时间更长,机械通气时间、拔管时间、住ICU时间缩短。2012年的PAD指南也对右美托咪定的临床应用价值给予了肯定[3]。但2017年KAWAZOE等[4]的研究却显示,右美托咪定并没有改善病人的28 d无呼吸机天数及病死率。最新版的《中国成人ICU镇痛和镇静指南》对右美托咪定也仅为弱推荐[5]。因此,我们认为有必要再次汇总相关文献,对其临床效果进行评估。
本Meta分析重新汇总了近十几年来高质量的RCT研究,特别是纳入了近3年新发表的研究结果。分析结果表明,相较于应用丙泊酚及苯二氮类药物的病人,应用右美托咪定病人的机械通气时间及ICU住院时间缩短,谵妄发生率降低,但28 d病死率两组差异无统计学意义。同时,应用右美托咪定的病人心动过缓及低血压的发生率更高。为进一步明确右美托咪定对ICU机械通气病人长期镇静和短期镇静的效果,本研究进行了亚组分析。结果表明,在长期镇静亚组中得出了与总体Meta分析相同的结论,但在短期镇静亚组中却发现右美托咪定未能缩短病人的机械通气时间和减少谵妄的发生,心动过缓及低血压的发生率仍高于对照组。既往一项针对CABG术后病人短期镇静的相关研究也得出了类似的结论:与异丙酚组相比,右美托咪定组吗啡和咪达唑仑的需求无明显差别,机械通气时间和ICU住院时间并未缩短[38]。总体来看,相对于目前应用广泛的其他镇静药物而言,右美托咪定虽然未能降低病人的病死率,但在缩短ICU机械通气病人机械通气时间、ICU住院时间方面仍有其优势,这对于促进病人病情恢复,避免病人在ICU期间再次发生感染有较大的意义,同时也会减少病人住院花费,减轻其经济负担。右美托咪定减少谵妄发生的作用不仅有利于病人康复,也会对病人的远期预后产生积极的影响,但由于缺乏相应数据,本文未能对病人的远期预后进行分析。应用右美托咪定的病人低血压、心动过缓的发生率较高,可能与右美托咪定作用于突触前α2受体,抑制去甲肾上腺素释放,抑制交感神经传导,增加迷走神经活性有关。可以通过减少负荷量剂量及输注速度来避免低血压及心动过缓发生,对于已经发生的病人,一般在暂停用药数分钟后可自行恢复,仅少数病人需使用药物来纠正。理论上右美托咪定可以很好地诱导浅镇静,同时兼具镇痛作用,在实现良好镇痛的同时可以减少吗啡、芬太尼等镇痛药物的用量。但对短期镇静亚组分析却得出了负面的结论,考虑其原因可能为:①纳入的研究数量少,样本量不足,无法得出阳性结果;②纳入3项研究均为术后病人,一般身体状况较好,较少发生撤机困难、谵妄等情况,因此在术后病人中应用右美托咪定在改善机械通气时间等指标上可能效果不明显。需要深入研究。
本研究存在一定的局限性:①某些研究提供的数据为中位数及四分位数形式,在应用适宜的统计学方法后虽然可将其最大限度地转化为近似的均数及标准差,但仍可能存在误差,影响分析结果;②本Meta分析漏斗图显示存在一定的发表偏倚,但并不严重;③纳入短期镇静组的研究数量较少,结果的可靠性有待进一步研究验证。
综上所述,相对于丙泊酚及苯二氮类药物而言,右美托咪定可以缩短病人的机械通气时间及ICU住院时间,降低谵妄发生率,但不能明显改善病人的28 d病死率;应用右美托咪定也意味着病人将面临更高的发生心动过缓及低血压的风险。对于术后短期镇静病人,右美托咪定并不能缩短病人的机械通气时间,减少谵妄的发生,而且心动过缓及低血压的发生率仍高于对照组。因此,对于ICU需要长期镇静的机械通气病人可以根据其病情、镇静目标等因素综合考虑选择使用右美托咪定,但对于存在心功能不全、血流动力学不稳定等因素的病人,应该更加谨慎地进行评估,如需使用则要在应用过程中加强监护。而对于短期镇静的机械通气病人,目前不推荐优先选用右美托咪定。
| [1] |
刘大为. 实用重症医学[M]. 2版. 北京: 人民卫生出版社, 2017.
|
| [2] |
易利丹, 彭六保, 谭重庆, 等. 新型镇静镇痛药——右美托咪定[J]. 中国新药与临床杂志, 2011, 30(1): 5-10. |
| [3] |
BARR J, FRASER G L, PUNTILLO K, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit[J]. Critical Care Medicine, 2013, 41(1): 263-306. |
| [4] |
KAWAZOE Y, MIYAMOTO K, MORIMOTO T, et al. Effect of dexmedetomidine on mortality and ventilator-free days in patients requiring mechanical ventilation with sepsis a randomized clinical trial[J]. JAMA, 2017, 317(13): 1321-1328. DOI:10.1001/jama.2017.2088 |
| [5] |
中华医学会重症医学分会. 中国成人ICU镇痛和镇静治疗指南[J]. 中华重症医学电子杂志(网络版), 2018, 4(2): 90-113. |
| [6] |
MACLAREN R, PRESLASKI C R, MUELLER S W, et al. A randomized, double-blind pilot study of dexmedetomidine versus midazolam for intensive care unit sedation:patient recall of their experiences and short-term psychological outcomes[J]. Journal of Intensive Care Medicine, 2015, 30(3): 167-175. DOI:10.1177/0885066613510874 |
| [7] |
ESMAOLGLU A, ULGEY A, AKIN A, et al. Comparison between dexmedetomidine and midazolam for sedation of eclampsia patients in the intensive care unit[J]. Journal of Critical Care, 2009, 24(4): 551-555. DOI:10.1016/j.jcrc.2009.02.001 |
| [8] |
TERAO Y, ICHINOMIYA T, HIGASHIJIMA U, et al. Comparison between propofol and dexmedetomidine in posto-perative sedation after extensive cervical spine surgery[J]. Journal of Anesthesia, 2012, 26(2): 179-186. DOI:10.1007/s00540-011-1300-7 |
| [9] |
READE M C, O'SULLIVAN K, BATES S, et al. Dexmedetomidinevs haloperidol in delirious, agitated, intubated patients:a randomised open-label trial[J]. Critical Care (London, England), 2009, 13(3): R75. DOI:10.1186/cc7890 |
| [10] |
PANDHARIPANDE P P, PUN B T, HERR D L, et al. Effect of sedation with dexmedetomidine vs lorazepam on acute brain dysfunction in mechanically ventilated patients:the MENDS randomized controlled trial[J]. JAMA, 2007, 298(22): 2644-2653. DOI:10.1001/jama.298.22.2644 |
| [11] |
CHEN Jie, ZHOU Jiaqian, CHEN Zhifeng, et al. Efficacy and safety of dexmedetomidine versus propofol for the sedation of tube-retention after oral maxillofacial surgery[J]. Journal of Oral and Maxillofacial Surgery, 2014, 72(2): e1-e7. |
| [12] |
GUPTA S, SINGH D, SOOD D, et al. Role of dexmedetomidine in early extubation of the intensive care unit patients[J]. Journal of Anaesthesiology, Clinical Pharmacology, 2015, 31(1): 92-98. DOI:10.4103/0970-9185.150554 |
| [13] |
MARTIN E, RAMSAY G, MANTZ J, et al. The role of the alpha2-adrenoceptor agonist dexmedetomidine in postsurgical sedation in the intensive care unit[J]. Journal of Intensive Care Medicine, 2004, 18(1): 29-41. |
| [14] |
RUOKONEN E, PARVIAINEN I, JAKOB S M, et al. Dexmedetomidine versus propofol/midazolam for long-term sedation during mechanical ventilation[J]. Intensive Care Me-dicine, 2009, 35(2): 282-290. DOI:10.1007/s00134-008-1296-0 |
| [15] |
RIKER R R, SHEHABI Y, BOKESCH P M, et al. Dexmedetomidine vs midazolam for sedation of critically ill patients:a randomized trial[J]. JAMA, 2009, 301(5): 489-499. DOI:10.1001/jama.2009.56 |
| [16] |
SHEHABI Y, BELLOMO R, READE M C, et al. Early goal-directed sedation versus standard sedation in mechanically ventilated critically ill patients:a pilot study[J]. Critical Care Medicine, 2013, 41(8): 1983-1991. DOI:10.1097/CCM.0b013e31828a437d |
| [17] |
ELBARADIE S, ELMAHALAWY F H. Dexmedetomidine vs propofol for short-term sedation of postoperative mechanically ventilated patients[J]. Journal of the Egyptian National Cancer Institute, 2004, 16(3): 153-158. |
| [18] |
JAKOB S M, RUOKONEN E, GROUNDS R M, et al. Dexmedetomidine vs midazolam or propofol for sedation during prolonged mechanical ventilation:two randomized controlled trials[J]. JAMA, 2012, 307(11): 1151-1160. DOI:10.1001/jama.2012.304 |
| [19] |
AHMED S, MURUGAN R. Dexmedetomidine use in the ICU:are we there yet[J]. ? Critical Care, 2013, 17(3): 320. DOI:10.1186/cc12707 |
| [20] |
HUANG Zhao, CHEN Yusheng, YANG Zili, et al. Dexmedetomidine versus midazolam for the sedation of patients with non-invasive ventilation failure[J]. Internal Medicine, 2012, 51(17): 2299-2305. DOI:10.2169/internalmedicine.51.7810 |
| [21] |
SRIVASTAVA V K, AGRAWAL S, KUMAR S, et al. Comparison of dexmedetomidine, propofol and midazolam for short-term sedation in postoperatively mechanically ventilated neurosurgical patients[J]. Journal of Clinical and Diagnostic Research:JCDR, 2014, 8(9): GC04-GC07. |
| [22] |
黄芳, 王俊, 杨新静, 等. 右美托咪定在老年患者外科术后机械通气中的镇静效果分析[J]. 中华医学杂志, 2014, 94(41): 3211-3215. DOI:10.3760/cma.j.issn.0376-2491.2014.41.003 |
| [23] |
宋瑞霞, 李俊艳, 董晨明, 等. 右美托咪定在ICU机械通气集束化治疗中的临床应用研究[J]. 中华危重病急救医学, 2015, 27(10): 836-840. DOI:10.3760/cma.j.issn.2095-4352.2015.10.011 |
| [24] |
郭丰, 王琦, 严春燕, 等. 不同镇静方案在感染性休克患者中的临床应用观察[J]. 中华医学杂志, 2016, 96(22): 1758-1761. DOI:10.3760/cma.j.issn.0376-2491.2016.22.010 |
| [25] |
OWUSU K, KURCZEWSKI L, ARMAHIZER M, et al. Dex-medetomidine versus propofol in neurocritical care:an evaluation of clinical utility and safety[J]. Critical Care Medicine, 2018, 46(1, 1): 358. |
| [26] |
BEN REHOUMA M, MOULIN C, MONTRAVERS P. The usefulness of dexmedetomidine after lung transplantation in intensive care unit[J]. Critical Care, 2018, 22(1): 502. |
| [27] |
MEMIS D, KARGI M, SUT N. Effects of propofol and dexmedetomidine on indocyanine green elimination assessed with LIMON to patients with early septic shock:a pilot study[J]. Journal of Critical Care, 2009, 24(4): 603-608. DOI:10.1016/j.jcrc.2008.10.005 |
| [28] |
OLOFSSON K, ALLING C, LUNDBERG, et al. Abolished circadian rhythm of melatonin secretion in sedated and artificially ventilated intensive care patients[J]. Acta Anaesthesiologica Scandinavica, 2004, 48(6): 679-684. DOI:10.1111/j.0001-5172.2004.00401.x |
| [29] |
ELY E W, SHINTANI A, TRUMAN B, et al. Delirium as a predictor of mortality in mechanically ventilated patients in the intensive care unit[J]. JAMA, 2004, 291(14): 1753-1762. DOI:10.1001/jama.291.14.1753 |
| [30] |
SEYMOUR C W, PANDHARIPANDE P P, KOESTNER T, et al. Diurnal sedative changes during intensive care:impact on liberation from mechanical ventilation and delirium[J]. Critical Care Medicine, 2012, 40(10): 2788-2796. DOI:10.1097/CCM.0b013e31825b8ade |
| [31] |
MANTZ J, JOSSERAND J, HAMADA S. Dexmedetomidine:new insights[J]. European Journal of Anaesthesiology, 2011, 28(1): 3-6. DOI:10.1097/EJA.0b013e32833e266d |
| [32] |
徐斐, 敖虎山. 盐酸右美托咪定的临床应用[J]. 中国循环杂志, 2015, 30(4): 401-403. DOI:10.3969/j.issn.1000-3614.2015.04.025 |
| [33] |
ALEXOPOULOU C, KONDILI E, DIAMANTAKI E, et al. Effects of dexmedetomidine on sleep quality in critically ill patients:a pilot study[J]. Anesthesiology, 2014, 121(4): 801-807. DOI:10.1097/ALN.0000000000000361 |
| [34] |
HUUPPONEN E, MAKSIMOW A, LAPINLAMPI P, et al. Electroencephalogram spindle activity during dexmedetomidine sedation and physiological sleep[J]. Acta Anaesthesiologica Scandinavica, 2008, 52(2): 289-294. DOI:10.1111/j.1399-6576.2007.01537.x |
| [35] |
DE WOLF A M, FRAGEN R J, AVRAM M J, et al. The pharmacokinetics of dexmedetomidine in volunteers with severe renal impairment[J]. Anesthesia and Analgesia, 2001, 93(5): 1205-1209. DOI:10.1097/00000539-200111000-00031 |
| [36] |
LEE S, KIM B H, LIM K, et al. Pharmacokinetics and pharmacodynamics of intravenous dexmedetomidine in healthy Korean subjects[J]. Journal of Clinical Pharmacy and Therapeutics, 2012, 37(6): 698-703. DOI:10.1111/j.1365-2710.2012.01357.x |
| [37] |
KOHLI U, PANDHARIPANDE P, MUSZKAT M A, et al. CYP2A6 genetic variation and dexmedetomidine disposition[J]. European Journal of Clinical Pharmacology, 2012, 68(6): 937-942. DOI:10.1007/s00228-011-1208-z |
| [38] |
CORBETT S M, REBUCK J A, GREENE C M, et al. Dex-medetomidine does not improve patient satisfaction when compared with propofol during mechanical ventilation[J]. Critical Care Medicine, 2005, 33(5): 940-945. DOI:10.1097/01.CCM.0000162565.18193.E5 |
 2019, Vol. 55
2019, Vol. 55

