2. 青岛大学附属医院口腔医学院, 山东 青岛 266003
牙龈退缩是临床常见问题,手术进行根面覆盖是治疗牙龈退缩的有效方法[1-2]。牙龈退缩后根面暴露伴发龋性或非龋性疾病是根面覆盖手术的治疗难点[3-4],寻找一种生物相容性良好的材料充填根面后再行根面覆盖术,降低材料对牙龈组织的细胞毒性,提高根面覆盖效果成为研究热点。本实验使用生物相容性良好的壳聚糖(CS)对玻璃离子水门汀(GIC)进行改性,进一步提高GIC的细胞相容性,从细胞水平评价CS改性GIC(CS-GIC)作为根面充填材料的可能性,为后续的体内实验奠定基础。
1 材料与方法 1.1 材料与试剂CS(分子量30 000,脱乙酰率90%)购自恒台县金湖甲壳制品有限公司;GIC(Fuji-Ⅸ)购自而至齿科(苏州)有限公司;α-MEM培养基、2.5 g/L胰蛋白酶、胎牛血清、PBS、CCK-8等试剂购自北京索莱宝科技有限公司。
1.2 实验方法 1.2.1 实验样本的制备在GIC液中分别添加质量分数0.01、0.02、0.04的CS粉末,磁力搅拌均匀后,放置在37 ℃、100%相对湿度的恒温箱内孵育至少24 h,然后按照说明书建议的粉液比进行调和。在材料未凝固之前,迅速将其灌入中空的聚乙烯模具中,模具两端盖上玻璃片并挤压,去除气泡及多余的材料。将材料连同模具、玻璃片等一起放置到37 ℃、100%相对湿度的恒温箱中,1 h后,从模具中取出材料,挑选无气泡、无毛边者继续放置在37 ℃、100%相对湿度的恒温箱中孵育至少24 h,以确保材料完全凝固。
1.2.2 傅里叶红外线光谱(FTIR)仪检测CS-GIC的光谱特征按照1.2.1的方法制备直径6 mm、厚度2 mm的CS-GIC样本,将其在石英研钵中研磨成粉状,取少量于FTIR仪器上进行扫描,光谱范围为4 000~500 cm-1。
1.2.3 人牙龈成纤维细胞(HGFs)的培养自我院口腔科门诊获取青少年因行开窗助萌术而切除的新鲜牙龈,在超净工作台内,用PBS流动冲洗组织块数次。分离并剪碎结缔组织,转移到培养瓶底,翻转培养瓶,加入含体积分数0.15胎牛血清和体积分数0.01双抗的α-MEM培养基3 mL,置于37 ℃、含体积分数0.05 CO2的培养箱中, 4 h后翻转培养瓶, 正常培养。当原代细胞从组织块爬出并铺满培养瓶底的80%时,使用2.5 g/L胰蛋白酶进行消化,以1:2或1:3传代。传代后的细胞使用含有体积分数0.10胎牛血清和体积分数0.01双抗的α-MEM完全培养基进行培养,并每隔3 d换液1次。
1.2.4 HGFs来源鉴定细胞传至第3代时,采用2.5 g/L胰蛋白酶进行消化,制备细胞爬片。使用40 g/L甲醛溶液固定后,常规免疫荧光法进行抗波形丝蛋白和抗角蛋白的荧光染色,并于倒置荧光显微镜下观察。
1.2.5 材料浸提液制备及pH值检测按照1.2.1的方法制备GIC(A组)、含质量分数0.01、0.02、0.04 CS的CS-GIC样本(B组、C组、D组),紫外线照射消毒后,放入无菌的完全培养基(含体积分数0.10胎牛血清、体积分数0.01双抗的α-MEM培养基)中,按照ISO推荐的浓度[5]在37 ℃下浸提24 h,得到浸提原液,并用完全培养基对浸提原液进行等体积比稀释,最终得到体积分数分别为1.00、0.50、0.25、0.13的浸提液。使用pH值检测仪对无菌的浸提液进行pH值检测。以完全培养基为空白对照(对照组)。
1.2.6 HGFs毒性检测取第5代生长状态良好的HGFs,制备密度7×107/L的细胞悬液。向96孔细胞培养板每孔加入100 μL的细胞悬液,以完全培养基为空白对照组,每板设空白对照组、A组、B组、C组和D组,其中A组为GIC组,B组、C组和D组分别为含体积分数0.01、0.02、0.04的CS-GIC组,每组设6个复孔。细胞培养24 h后,弃上清液,各组每孔加入100 μL相应浸提液(空白对照组每孔加入100 μL新鲜的完全培养基)。再次培养24 h后,弃上清液,加入100 μL完全培养基和10 μL CCK-8试剂,37 ℃避光孵育1.5 h,上全自动酶标仪检测450 nm波长处每孔的吸光度(A)值,计算细胞相对增殖率(RGR,RGR=实验组A值/对照组A值),并按5级毒性分级法评价材料的毒性[6]:RGR≥100%时,细胞的毒性评级为0级;RGR为75%~99%时,细胞毒性评级为1级;RGR为50%~74%时,细胞毒性评级为2级;RGR为25%~49%时,细胞毒性评级为3级;RGR为0~24%时,细胞毒性评级为4级。
1.3 统计学方法应用SPSS 24.0软件进行统计学处理,计量资料结果以x±s表示,多组之间比较采用析因设计的方差分析,两组之间比较采用LSD比较。P < 0.05为差异有统计学意义。
2 结果 2.1 FTIR检测CS-GIC在1 716 cm-1处出现了一个新的特征峰,这一特征峰的出现与N-C=O化学键的特征峰一致,即CS中的氨基与GIC液主要成分聚丙烯酸中的羧基反应生成的新化学键的特征峰相一致。另外,CS-GIC在2 920 cm-1和2 880 cm-1处出现了与C-H化学键一致的特征峰,这一特征峰较GIC和CS中的特征峰更加明显。见图 1。
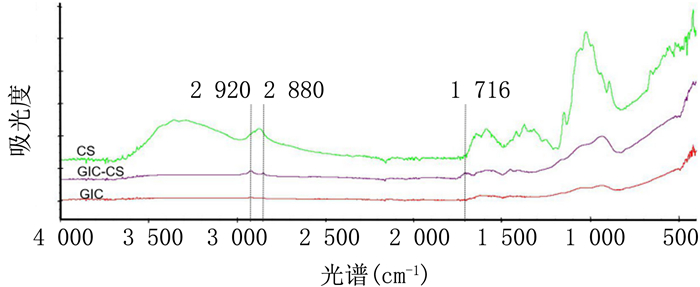 |
| 图 1 CS-GIC的红外线光谱图 |
大约在培养第7天时,原代细胞开始从组织块爬出,细胞呈长梭形,细胞质丰富,核圆形或者椭圆形,呈现出成纤维细胞形态(图 2a)。原代细胞生长较快,约4 d后,开始传代,传代后的细胞呈现出更加典型的成纤维细胞样(图 2b)。
 |
| a为原代细胞;b为第3代细胞。40倍。 图 2 光学显微镜下细胞形态 |
细胞抗波形丝蛋白染色呈阳性,细胞抗角蛋白染色呈阴性,说明细胞来源于中胚层组织,而不是上皮组织。
2.4 不同材料浸提液的pH值比较材料与浓度之间存在交互作用(F=89.97,P < 0.001)。在浸提液体积分数1.00的浓度下,GIC组和CS-GIC各组的pH值显著低于空白对照组(F= 465.76,P < 0.01)。在体积分数1.00和0.50的浸提液浓度下,含质量分数0.02的CS-GIC组的pH值较GIC组更接近中性,差异有统计学意义(F=465.76、35.96,P < 0.01)。在体积分数0.25和0.13的浸提液浓度下,各组间pH值比较差异无统计学意义(P>0.05)。见表 1。
| 表 1 各材料不同浓度浸提液的pH值比较(n=6, x±s) |
|
|
在体积分数1.00的浸提液浓度下,GIC和CS-GIC各组中的大部分细胞皱缩、变圆。在体积分数0.50、0.25和0.13的浸提液浓度下,所有组的细胞生长状态良好,细胞呈长梭形,细胞质丰富,核圆形或者椭圆形,呈放射状排列。另外,所有组细胞形态未见明显差异(图 3)。
 |
| a~d浸提液的浓度分别为体积分数1.00、0.50、0.25和0.13;1~5分别代表空白对照组,GIC组,含质量分数0.01、0.02和0.04的CS-GIC组。40倍。 图 3 光镜下HGFs在不同材料、不同浓度浸提液中的生长情况 |
材料与浓度之间存在交互的作用(F=310.76,P < 0.001)。在体积分数为1.00的浸提液浓度下,GIC组和CS-GIC各组的A值显著低于空白对照组(F=1 606.24,P < 0.01),细胞毒性评级为4级。在体积分数0.50和0.25的浸提液浓度下,虽然GIC组和CS-GIC各浓度组的A值仍显著低于空白对照组(F=380.20、54.62,P < 0.01),但含质量分数0.02 CS的CS-GIC组的A值明显高于GIC组,细胞毒性评级也较低。当浸提液浓度稀释到体积分数0.13时,GIC和CS-GIC各组的A值与空白对照组比较差异无显著性(P>0.05)。见表 2、3。
| 表 2 不同材料、不同含量浸提液培养后细胞A值比较(n=6, x±s) |
|
|
| 表 3 不同材料的RGR和细胞毒性评级 |
|
|
GIC是临床上常用的牙体充填材料,曾被应用于龈下充填,包括根折、牙根外吸收和根管侧穿的修复[7]。近几年,许多学者将GIC及其改性产品用于根面充填并在其表面行根面覆盖术,用以治疗牙龈退缩伴根面龋性或非龋性疾病。ALKAN等[8]及SANTAMARIA等[9-10]通过个案报道、随机对照研究等发现,在树脂加强型GIC表面行根面覆盖术,术后牙龈探诊深度在正常范围,附着丧失明显改善,且龈沟液内炎症因子水平和龈下菌斑微生物的量与对照组比较无明显差异。然而,学者们关于GIC的细胞毒性仍存在争议。一些学者经过体外研究发现,GIC和树脂加强型GIC对体外细胞具有明显的细胞毒性[11-13]。随着材料科学的发展,具有更好生物相容性的生物陶瓷材料——矿物三氧化物凝聚体(MTA)和iRoot等相继问世,已经应用于龈下缺损的修补[14-17]。但临床应用和实验研究发现,上述材料临床应用时由于性能不佳、固化时间较长、与牙体组织的粘结强度不高以及价格昂贵等[18],并不适用于牙颈部大面积牙体组织缺损的充填修复。
CS是自然界中唯一带正电荷的碱性多糖,它可以通过局部中和反应产生抗炎作用,形成的氨基葡萄糖酸盐或其他盐,可被发炎的结缔组织或软骨组织吸收,促进其修复和再生[19]。CS还能通过调节细胞增殖来促进细胞再生和伤口愈合[20]。另外,CS具有黏膜黏附性、抗菌性和降解性等许多优良的性能,使其成为研究的热点,被广泛应用于各个领域。CS在牙科领域的研究,也早有报道。2007年,PETRI等[21]学者使用质量分数0.004 4的CS对GIC进行改性,结果显示改性后的CS-GIC具有更高的弯曲强度以及更强的氟离子释放能力。2017年,DEBNATH等[22]学者将体积分数0.10的CS溶液与GIC液相结合,发现其可显著改善GIC的抗菌性能及对釉质的粘结性能。然而,这些研究主要集中在对材料的机械性能、与牙体组织的粘结性能和抗菌性能的改进上,有关CS-GIC细胞毒性方面的研究甚少。本文实验设计了质量分数0.01、0.02和0.04共3种浓度的CS,应用其对GIC进行改性,观察其细胞毒性的大小,以期为其用于龈下大面积充填提供依据。FTIR检测结果显示,CS改性后的GIC在1 716 cm-1处出现新的特征峰,这是因为CS分子链中的氨基(NH2)与GIC液主要成分聚丙烯酸中的羧基发生反应生成新的化学键(N-C=O)引起的,这也证实了CS成功整合到GIC中。
本实验按照ISO的标准制备了不同浓度的浸提液,并使用CCK-8试剂进行检测。结果显示,在浸提液体积分数1.00的浓度下,GIC组和CS-GIC各组的A值显著低于空白对照组,大部分细胞形态出现皱缩变圆,表现出了明显的细胞毒性。该结果与以往文献结果相似[12, 23-24]。STANISLAWSKI等[25]研究显示,GIC造成周围环境pH值的降低是引起细胞毒性的原因之一;SMITH等[23]研究也认为, GIC的低pH值会造成牙髓细胞的敏感甚至坏死。本文研究结果显示,GIC组和CS-GIC各组的体积分数1.0浸提液pH值均显著低于空白对照组,表现出明显的酸性,其对应的细胞毒性也高;随着浸提液浓度被稀释,其pH值逐渐接近中性,细胞毒性也逐渐降低。
本文结果还显示,在体积分数1.00和0.50的浸提液浓度下,含质量分数0.02 CS的CS-GIC组较GIC组和其他CS-GIC组pH值更接近中性,说明含质量分数0.02 CS的CS-GIC引起周围环境pH值降低的程度更低。PETRI等[21]研究发现,质量分数0.004 4的CS添加到GIC中,可以增加氟离子(F-)的释放量,这些F-会消耗周围环境的H+生成HF等非游离性酸根离子,从而降低周围环境的酸度。因此,推测含质量分数0.02 CS的CS-GIC组较其他组所消耗的游离H+更多,从而使周围环境的pH值更接近中性,但具体机制尚待进一步研究。另外,本文结果还显示,含质量分数0.02 CS的CS-GIC组较GIC和其他CS-GIC组的pH值更接近中性,细胞毒性也更低。这也说明GIC的细胞毒性与其引起周围环境pH值降低有关。
在临床实践中,牙颈部周围的根面缺损充填后,材料将长期处于龈沟液的浸泡中,材料中的酸根离子或其他有毒成分将渗透到龈沟液中,影响牙龈组织的健康。正常情况下,单个牙位短时间内的龈沟液量很少,用滤纸条采集30 s的龈沟液样本量 < 1 μL[26]。因此,龈沟液中短时间内的材料浸提液浓度很高,对牙龈组织的影响也较大;但随着时间的延长和龈沟液、唾液不断的冲刷,局部浸提液浓度逐渐降低。然而,由于体内环境的复杂性,单纯依靠体外实验难以更好地模拟体内环境,因此还需要进行体内试验。
综上所述,含质量分数0.02 CS的CS-GIC能降低周围环境的酸度,从而降低材料的细胞毒性,但仍需要进行体内研究,以进一步评价CS-GIC能否降低材料对牙龈组织的毒性,促进根面覆盖术后的牙龈组织与材料之间的粘结,为治疗牙龈退缩伴牙颈部疾病提供一种新的方法。
| [1] |
郭云, 曹正国. 上皮下结缔组织移植联合冠向复位瓣改善下前牙牙龈退缩一例[J]. 中华口腔医学杂志, 2018, 53(3): 169-172. DOI:10.3760/cma.j.issn.1002-0098.2018.03.005 |
| [2] |
戴安娜, 丁佩惠, 唐琪, 等. 牙周根面覆盖术治疗牙龈退缩的长期疗效观察[J]. 中华口腔医学杂志, 2019, 54(2): 124-129. DOI:10.3760/cma.j.issn.1002-0098.2019.02.009 |
| [3] |
DELIBERADOR T M, MARTINS T M, FURLANETO F A, et al. Use of the connective tissue graft for the coverage of composite resin-restored root surfaces in maxillary central incisors[J]. Quintessence International, 2012, 43(7): 597-602. |
| [4] |
皇甫若奇, 徐晓. 牙齿非龋性颈部缺损疾病的研究回顾[J]. 口腔材料器械杂志, 2010, 19(1): 26-29. DOI:10.3969/j.issn.1004-7565.2010.01.008 |
| [5] |
MULLER B P, ELSENTRAGER A, JAHNEN-DECHENT W, et al. Effect of sample preparation on the in vitro genoto-xicity of a light curable glass ionomer cement[J]. Biomate-rials, 2003, 24(4): 611-617. DOI:10.1016/S0142-9612(02)00375-7 |
| [6] |
张彩霞. 应用细胞培养法对复合树脂充填材料的毒性研究[J]. 口腔医学, 1982, 2(1): 40-58. |
| [7] |
南晓红, 寇继寅, 李茹. 玻璃离子水门汀的应用及发展[J]. 口腔医学, 2007, 27(6): 323-325. |
| [8] |
ALKAN A, KESKINER I, YUZBASIOGLU E. Connective tissue grafting on resin ionomer in localized gingival recession[J]. Journal of Periodontology, 2006, 77(8): 1446-1451. DOI:10.1902/jop.2006.060021 |
| [9] |
SANTAMARIA M P, SUAID F F, CASATI M Z, et al. Coronally positioned flap plus resin-modified glass ionomer restoration for the treatment of gingival recession associated with non-carious cervical lesions:a randomized controlled clinical trial[J]. J Periodontol, 2008, 79(4): 621-628. DOI:10.1902/jop.2008.070285 |
| [10] |
SANTAMARIA M P, CASATI M Z, NOCITI J, et al. Connective tissue graft plus resin-modified glass ionomer restoration for the treatment of gingival recession associated with non-carious cervical lesions:microbiological and immunological results[J]. Clinical Oral Investigations, 2013, 17(1): 67-77. DOI:10.1007/s00784-012-0690-8 |
| [11] |
DE SOUZA COSTA C A, HEBLING J, GARCIA-GODOY F, et al. In vitro cytotoxicity of five glass-ionomer cements[J]. Biomaterials, 2003, 24(21): 3853-3858. DOI:10.1016/S0142-9612(03)00253-9 |
| [12] |
RODRIGUEZ I A, ROZAS FERRARA C A, CAMPOS-SANCHEZ F, et al. An in vitro biocompatibility study of conventional and resin-modified glass ionomer cements[J]. Journal of Adhesive Dentistry, 2013, 15(6): 541-546. |
| [13] |
MARCZUK K G, LUCZAJ C E, PAWINSKA M, et al. Eva-luation of the cytotoxicity of selected conventional glass ionomer cements on human gingival fibroblasts[J]. Advances in Clinical and Experimental Medicine, 2017, 26(7): 1041-1045. DOI:10.17219/acem/64944 |
| [14] |
张竹, 李茗慧. iRoot BP Plus在老年根尖手术中的应用研究[J]. 中华老年口腔医学杂志, 2016, 14(6): 326-329. DOI:10.3969/j.issn.1672-2973.2016.06.002 |
| [15] |
王密, 尹世海, 王奇, 等. iRoot BP修复磨牙髓室底穿孔的研究[J]. 华西口腔医学杂志, 2013, 31(3): 257-266. |
| [16] |
邓金勇, 李艳莉. 三氧化矿物凝聚体修补根管侧穿、髓底穿孔的临床效果[J]. 中国医学前沿杂志(电子版), 2015, 7(7): 115-118. DOI:10.3969/j.issn.1674-7372.2015.07.027 |
| [17] |
侯文贤. 用三氧化矿物凝聚体对86例髓底穿通和根管侧穿修补治疗的临床观察[J]. 口腔医学, 2014, 34(10): 797-798. |
| [18] |
王芬, 武金明, 薛明. 根管封闭剂iRoot SP根尖封闭性能评价[J]. 上海口腔医学, 2013, 22(2): 156-159. |
| [19] |
XIA Wenshui, LIU Ping, ZHANG Jiali, et al. Biological activities of chitosan and chitooligosaccharides[J]. Food Hydrocolloids, 2011, 25(2): 170-179. DOI:10.1016/j.foodhyd.2010.03.003 |
| [20] |
李若慧, 张雪, 单丹彤, 等. 壳聚糖的生物相容性[J]. 中国组织工程研究, 2012, 16(12): 2237-2240. DOI:10.3969/j.issn.1673-8225.2012.12.034 |
| [21] |
PETRI D F, DONEGA J, BENASSI A M. Preliminary study on chitosan modified glass ionomer restoratives[J]. Dental Materials, 2007, 23(8): 1004-1010. DOI:10.1016/j.dental.2006.06.038 |
| [22] |
DEBNATH A, KESAVAPPA S B, SINGH G P, et al. Comparative evaluation of antibacterial and adhesive properties of chitosan modified glass ionomer cement and conventional glass ionomer cement:an in vitro study[J]. J Clin Diagn Res, 2017, 11(3): ZC75-ZC78. |
| [23] |
SMITH D C, RUSE N D. Acidity of glass ionomer cements during setting and its relation to pulp sensitivity[J]. J Am Dent Assoc, 1986, 112(5): 654-657. DOI:10.14219/jada.archive.1986.0069 |
| [24] |
LEWIS J, NIX L, SCHUSTER G, et al. Response of oral mucosal cells to glass ionomer cements[J]. Biomaterials, 1996, 17(11): 1115-1120. DOI:10.1016/0142-9612(96)85913-8 |
| [25] |
STANISLAWSKI L, DANIAU X, LAUTIE A, et al. Factors responsible for pulp cell cytotoxicity induced by resin-modified glass ionomer cements[J]. Journal of Biomedical Materials Research, 1999, 48(3): 277-288. DOI:10.1002/(SICI)1097-4636(1999)48:3<277::AID-JBM11>3.0.CO;2-T |
| [26] |
陈智滨, 孙晓军, 寇传哲, 等. 龈沟液微量样本中多种成分的检测[J]. 北京大学学报(医学版), 2008, 40(1): 57-59. DOI:10.3321/j.issn:1671-167X.2008.01.014 |
 2019, Vol. 55
2019, Vol. 55

