骨肉瘤好发于青少年人群,恶性程度高,可早期发生转移,复发率较高,预后多不良[1],严重威胁病人生存健康。近年来,虽然临床诊疗水平不断进步,但骨肉瘤病人复发率和5年生存率并未得到明显改善[2]。有研究指出,骨肉瘤细胞增殖、分化、侵袭、转移能力强是影响肿瘤预后的主要因素[3]。但目前影响骨肉瘤细胞增殖、侵袭、转移的机制尚未完全清楚。Polo样激酶1(PLK1)是PLK家族重要成员,是一种高度保守的丝/苏氨酸蛋白激酶,在细胞分裂、DNA损伤修复中发挥重要作用[4]。有研究指出,PLK1在多种恶性肿瘤中呈高表达,参与了肿瘤发生、进展过程[5]。本研究利用小分子干扰RNA(siRNA)技术特异性沉默人骨肉瘤MG-63细胞系中的PLK1基因,观察其对细胞生物学特性的影响,以期为骨肉瘤机制研究及临床诊治提供基础资料。现将结果报告如下。
1 材料与方法 1.1 主要材料人骨肉瘤MG-63细胞系购自美国ATCC公司,RPMI-1640培养液、胎牛血清购自美国Gibco公司,Trizol总RNA提取试剂盒购自北京百泰克生物技术公司,Lipofectamine2000转染试剂购自北京方程佰金科技公司,逆转录和PCR试剂盒购自日本TaKaRa公司,PLK1及内参引物由上海生工生物公司设计合成,siRNA-PLK1、siRNA-对照序列由上海吉玛制药技术公司设计合成,Transwell小室购自美国Millipore公司,兔抗人PLK1多克隆抗体购自美国Calbiochem公司,Annexin V-FITC/PI细胞凋亡检测试剂盒、流式细胞仪购自美国BD公司,凝胶电泳分析系统购自美国Bio-rad公司。
1.2 实验方法 1.2.1 细胞培养及分组MG-63细胞加含体积分数0.10胎牛血清的RPMI-1640培养液,置于含体积分数0.05 CO2、37 ℃恒温培养箱中培养。待细胞融合度达到80%左右时传代。取对数生长期的细胞进行转染[6],并将细胞分为以下3组。①空白组(A组):不作任何处理;②siRNA-对照序列组(B组):转染对照序列5′-AAUUUGGCCGGGCCGU- GCG-3′;③siRNA-PLK1组(C组):转染PLK1基因的siRNA序列5′-AAGGGCGGCUUUGCCAA- GUGC-3′。各组转染完成后继续恒温培养24 h,完成后续实验。
1.2.2 实时荧光定量PCR技术检测细胞中PLK1基因表达取各组转染后培养48 h的细胞,胰酶消化后,用裂解液裂解,按Trizol总RNA提取试剂盒说明提取总RNA,并检测纯度和浓度,将其反转录为cDNA,以cDNA为模板行PCR。PLK1及内参引物序列见表 1。PCR反应条件为:95 ℃、3 min,95 ℃、40 s,58 ℃、40 s,70 ℃、40 s,循环36次。每个样本均设6个平行复孔。用2-△△Ct法计算各组细胞中PLK1 mRNA相对表达量[7]。
| 表 1 PLK1及内参引物序列 |
|
|
取各组转染后培养48 h的细胞,胰酶消化后用裂解液裂解,提取细胞中总蛋白,用BCA总蛋白检测试剂盒检测蛋白纯度和浓度。取30 μg总蛋白,行SDS-聚丙烯酰胺凝胶电泳,电转至PVDF膜,室温下用含50 g/L脱脂奶粉的TBST封闭60 min,加入一抗兔抗人PLK1多克隆抗体(稀释比例1:1 000),4 ℃过夜孵育,TBST洗膜3次,加入二抗,室温下孵育120 min,TBST洗膜3次,加入ECL避光反应25 min,拍照,应用Image J图像分析软件对灰度值进行定量分析,获得各组细胞中PLK1蛋白相对表达量[8]。
1.2.4 CCK-8法检测细胞增殖活性取各组转染后培养48 h的细胞,消化后接种于96孔板中,将细胞密度调整为每孔2×104个,置于含体积分数0.05 CO2的37 ℃恒温培养箱中培养。分别于培养24、48、72和96 h时,将孔板中的培养液去除,加入100 μL的无血清培养液和10 μL的CCK-8溶液,空白组仅加入无血清培养液,继续37 ℃恒温孵育120 min。用酶标仪在490 nm波长处检测各孔吸光度(A)值[9]。
1.2.5 流式细胞术检测细胞凋亡取各组转染后培养48 h的细胞,胰酶消化后收集细胞,用4 ℃预冷的PBS洗涤3次,用1×缓冲液重悬细胞,调整细胞密度为1×109/L,取100 μL细胞悬液加入流式管中,再分别加入5 μL的Annexin V-FITC和PI,摇匀,室温下在暗室中孵育20 min,60 min内上机检测[10]。
1.2.6 Transwell法检测细胞迁移和侵袭能力迁移能力检测:取各组转染后培养48 h的细胞,消化,离心,用无血清培养液重悬细胞并计数,取2×104个细胞加入小室上室,将含体积分数0.20胎牛血清的RPMI-1640培养液600 μL加入下室,培养24 h,甲醛固定,10 g/L结晶紫染色,将散落的细胞用棉签轻轻去除,以PBS冲洗3次,拍照,于高倍镜下随机取5个视野计数穿膜细胞数[11-12]。侵袭能力检测:取50 μL的Matrigel胶平铺于Transwell小室内侧,风干后备用;其余步骤同迁移能力检测。
1.3 统计学分析使用SPSS 17.0软件进行统计学分析,计量资料数据以x±s表示,多组间比较采用单因素方差分析和LSD-t检验,重复测量资料的比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 PLK1在各组细胞中的表达与空白组和siRNA-对照序列组比较,siRNA-PLK1组细胞中PLK1 mRNA和蛋白相对表达量均降低,差异有统计学意义(F=129.125、62.363,P<0.01)。见表 2和图 1。
| 表 2 各组细胞中PLK1 mRNA和蛋白表达比较(n=6,x±s) |
|
|
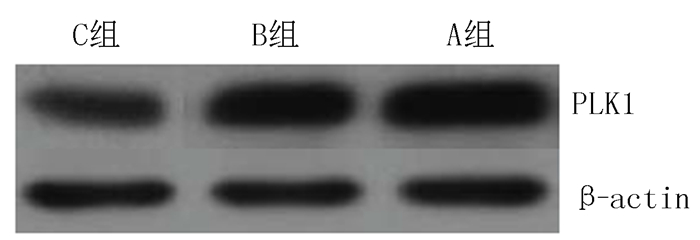 |
| 图 1 Western blot法检测各组细胞中PLK1蛋白表达 |
与空白组和siRNA-对照序列组比较,siRNA-PLK1组细胞培养48、72和96 h时的A值均降低,差异有统计学意义(F组间=32.021,F时间=357.249,F交互=5.755,P<0.01)。见表 3。
| 表 3 各组培养不同时间细胞增殖活性的比较(n=6,A,x±s) |
|
|
siRNA-PLK1组、siRNA-对照序列组和空白组细胞凋亡率分别为(6.7±2.2)%、(6.5±0.9)%和(14.9±1.4)%,与空白组和siRNA-对照序列组比较,siRNA-PLK1组细胞凋亡率升高,差异有统计学意义(F=69.863,P<0.01)。
2.4 各组细胞迁移和侵袭能力比较siRNA-PLK1组迁移细胞数和侵袭细胞数均低于空白组和siRNA-对照序列组,差异有统计学意义(F=28.998、34.783,P<0.01)。见表 4。
| 表 4 各组细胞迁移和侵袭能力比较(n=6,x±s) |
|
|
骨肉瘤作为严重威胁青少年健康的常见恶性肿瘤,具有较强的侵袭、转移能力,约20%的病人在临床确诊时已出现肺转移,约50%的病人在治疗过程中发生肺转移[13-15]。目前,骨肉瘤病人整体治疗效果仍不佳,多数病人预后不良,5年生存率尚不足30%[16]。细胞异常增殖和侵袭是骨肉瘤发生远处转移及治疗失败的主要原因[17-18]。PLK1作为丝/苏氨酸激酶家族成员,在调控细胞周期、促进有丝分裂及胞质分裂中发挥关键性作用[19-20]。研究表明,多数恶性肿瘤组织中PLK1呈高表达,且与病人预后有关[21-23]。抑制或敲除PLK1基因可促进肿瘤细胞凋亡,增加其对化疗药物的敏感性,且不会对正常细胞产生影响[24]。有研究表明,PLK1抑制剂可抑制骨肉瘤细胞的增殖,且PLK1蛋白水平的高表达与病人不良预后密切相关[25]。
本研究利用siRNA技术特异性下调骨肉瘤细胞中PLK1表达,结果显示,siRNA-PLK1组细胞中PLK1 mRNA和蛋白相对表达量均显著降低,表明PLK1基因表达被抑制。进一步的实验结果显示,siRNA-PLK1组细胞培养48、72和96 h时的A值均较siRNA-对照序列组和空白组明显降低,说明特异性抑制PLK1基因表达可有效抑制骨肉瘤细胞增殖,这与以往的有关研究结论相一致[26]。刘晓影等[27]通过建立食管鳞癌细胞裸鼠移植瘤研究显示,下调PLK1表达可抑制移植瘤的生长。本研究结果显示,特异性抑制骨肉瘤细胞中PLK1基因表达后,骨肉瘤细胞凋亡率显著增加,说明抑制PLK1基因表达可促进骨肉瘤细胞凋亡。毛永欢等[28]的研究结果亦表明,靶向沉默PLK1基因可促进胰腺癌细胞凋亡。有研究表明,PLK1基因与细胞分裂关系密切,在肝癌等实体肿瘤细胞侵袭、迁移中发挥重要作用[29]。丁克云等[30]研究表明,干扰PLK1表达可抑制恶性黑素瘤细胞的侵袭,其机制可能与诱导失巢凋亡有关。本研究结果显示,siRNA-PLK1组迁移细胞数和侵袭细胞数较siRNA-对照序列组和空白组均减少,说明PLK1基因表达与骨肉瘤细胞迁移、侵袭能力有关,提示PLK1基因可能参与了骨肉瘤细胞侵袭、迁移过程,并在此过程中发挥重要作用。
综上所述,沉默PLK1基因表达可抑制骨肉瘤细胞增殖、促进肿瘤细胞凋亡,并且可抑制骨肉瘤细胞迁移、侵袭能力,有望为骨肉瘤临床诊疗提供新的靶位。下一步我们将从分子生物学角度更加深入探讨PLK1在骨肉瘤发生及进展中的作用机制。
| [1] |
WAN Jia, ZHANG Xianghong, LIU Tang, et al. Strategies and developments of immunotherapies in osteosarcoma[J]. Oncology Letters, 2016, 11(1): 511-520. DOI:10.3892/ol.2015.3962 |
| [2] |
CHEN Yu, XU Songfeng, XU Ming, et al. Postoperative infection and survival in osteosarcoma patients:reconsideration of immunotherapy for osteosarcoma[J]. Mol Clin Oncol, 2015, 3(3): 495-500. DOI:10.3892/mco.2015.528 |
| [3] |
DAI Faxiang, XUAN Yi, JIN Jiejie, et al. CtBP2 overexpression promotes tumor cell proliferation and invasion in gastric cancer and is associated with poor prognosis[J]. Oncotarget, 2017, 8(17): 28736-28749. |
| [4] |
KUMAR S, SHARMA A R, SHARMA G, et al. PLK-1:angel or devil for cell cycle progression[J]. Biochimica et Biophysica Acta, 2016, 1865(2): 190-203. |
| [5] |
LIU Zhixian, SUN Qingrong, WANG Xiaosheng. PLK1, a potential target for cancer therapy[J]. Translational Oncology, 2017, 10(1): 22-32. DOI:10.1016/j.tranon.2016.10.003 |
| [6] |
司晓辉, 孙攀兴, 杜增利. 沉默WISP3基因抑制子宫内膜癌细胞增殖及侵袭力[J]. 齐鲁医学杂志, 2017, 32(6): 631-635. |
| [7] |
余俊, 刘彤鸥, 李晓兰. 小分子干扰RNA沉默黏着斑激酶基因对人宫颈癌Hela细胞生物学特征的影响[J]. 新乡医学院学报, 2018, 35(4): 266-271. |
| [8] |
李国彬, 张占成, 王新颜. 上调miR-200b对人喉癌Hep-2细胞增殖、迁移和侵袭能力的影响[J]. 山东大学耳鼻喉眼学报, 2018, 32(4): 53-57. |
| [9] |
陈晓琦, 蒋晶, 陈欣菊, 等. 冬凌草甲素固体脂质纳米粒干预食管癌细胞的增殖[J]. 中国组织工程研究, 2017, 21(34): 5460-5466. DOI:10.3969/j.issn.2095-4344.2017.34.009 |
| [10] |
周宁, 戴旖旎, 白旭光, 等. 姜黄素对肝癌细胞凋亡及TNF-ɑ、IL-1β、IL-6炎性因子影响的机制研究[J]. 癌症进展, 2017, 15(11): 1282-1285. |
| [11] |
李大刚, 李辉宗, 康乐. Vav3在小细胞肺癌组织中的表达及对细胞迁移和侵袭能力的影响[J]. 中国现代医学杂志, 2018, 28(24): 32-37. DOI:10.3969/j.issn.1005-8982.2018.24.006 |
| [12] |
罗玉政, 陈波, 李红樱. 沉默IGF1R表达对胃癌细胞侵袭与迁移能力的影响及机制[J]. 中国临床研究, 2018, 31(2): 163-166. |
| [13] |
任娟, 徐叶峰, 匡唐洪, 等. 104例骨肉瘤肺转移患者的预后及其影响因素[J]. 中华肿瘤杂志, 2017, 39(4): 263-268. DOI:10.3760/cma.j.issn.0253-3766.2017.04.005 |
| [14] |
陈瑞玲, 王刚阳, 孙梦熊, 等. 骨肉瘤精准医学的实践与进展[J]. 中华实验外科杂志, 2018, 35(6): 1190-1194. DOI:10.3760/cma.j.issn.1001-9030.2018.06.064 |
| [15] |
方三高, 马强, 杜娟, 等. 高级别表面骨肉瘤临床病理分析并文献复习[J]. 现代肿瘤医学, 2018, 26(9): 1431-1436. DOI:10.3969/j.issn.1672-4992.2018.09.030 |
| [16] |
KAMAL A F, WIDYAWARMAN H, HUSODO K, et al. Clinical outcome and survival of osteosarcoma patients in cipto mangunkusumo hospital:limb salvage surgery versus amputation[J]. Acta Medica Indonesiana, 2016, 48(3): 175-183. |
| [17] |
LU M H, FAN M F, YU X D. NSD2 promotes osteosarcoma cell proliferation and metastasis by inhibiting E-cadherin expression[J]. European Review for Medical and Pharmacological Sciences, 2017, 21(5): 928-936. |
| [18] |
张景航, 康小红, 路平, 等. 长链非编码RNA MALAT1在骨肉瘤组织中的表达及其对骨肉瘤细胞侵袭和转移的影响[J]. 中华病理学杂志, 2016, 45(8): 561-565. DOI:10.3760/cma.j.issn.0529-5807.2016.08.013 |
| [19] |
赫玮. Polo样蛋白激酶1参与有丝分裂调控的研究进展[J]. 医学综述, 2015, 21(20): 3659-3661. DOI:10.3969/j.issn.1006-2084.2015.20.005 |
| [20] |
周炳娟, 马秋双, 孙吉瑞, 等. 乳腺癌组织中FOXM1和PLK1的表达及意义[J]. 肿瘤防治研究, 2017, 44(3): 193-196. DOI:10.3971/j.issn.1000-8578.2017.03.008 |
| [21] |
WENGNG W T, SHIN J S, ROBERTS T L, et al. Molecular interactions of polo-like kinase 1 in human cancers[J]. Journal of Clinical Pathology, 2016, 69(7): 557-562. DOI:10.1136/jclinpath-2016-203656 |
| [22] |
陈阳, 姚燕丹, 罗曼莉, 等. PLK1调控Pin1促进乳腺癌对他莫昔芬耐药的机制[J]. 热带医学杂志, 2018, 18(3): 294-297. DOI:10.3969/j.issn.1672-3619.2018.03.005 |
| [23] |
屈佳妮, 甘润良, 唐运莲. PLK1抑制剂Volasertib靶向治疗肿瘤的研究进展[J]. 中南医学科学杂志, 2018, 46(2): 209-213. |
| [24] |
ZHAO C L, JU J Y, GAO W, et al. Downregulation of PLK1 by RNAi attenuates the tumorigenicity of esophageal squamous cell carcinoma cells via promoting apoptosis and inhibiting angiogenesis[J]. Neoplasma, 2015, 62(5): 748-755. DOI:10.4149/neo_2015_089 |
| [25] |
黄崇新, 吕波, 王跃, 等. PLK1抑制剂对骨肉瘤细胞增殖的影响及其机制研究[J]. 骨科, 2016, 7(5): 358-363. DOI:10.3969/j.issn.1674-8573.2016.05.014 |
| [26] |
MAO Yonghuan, XI Ling, LI Quan, et al. Regulation of cell apoptosis and proliferation in pancreatic cancer through PI3K/Akt pathway via Polo-like kinase 1[J]. Oncology Reports, 2016, 36(1): 49-56. DOI:10.3892/or.2016.4820 |
| [27] |
刘晓影, 陈丽梅, 张宝刚, 等. 慢病毒介导的人PLK1 RNA干扰对食管鳞癌细胞裸鼠移植瘤的抑制作用及机制[J]. 中国药理学通报, 2013, 29(11): 1528-1532. DOI:10.3969/j.issn.1001-1978.2013.11.013 |
| [28] |
毛永欢, 李泉, 蔡则灵, 等. Polo样激酶1对胰腺癌细胞株PANC-1凋亡、侵袭和迁移的影响[J]. 中华实验外科杂志, 2016, 33(11): 2535-2537. DOI:10.3760/cma.j.issn.1001-9030.2016.11.029 |
| [29] |
于慧杰, 吴晔, 李峰生, 等. 敲低Plk1对人肝癌血管内皮细胞迁移影响研究[J]. 中华肿瘤防治杂志, 2015, 22(8): 584-587. |
| [30] |
丁克云, 徐娟, 满昌峰, 等. RNA干扰下调PLK1基因对恶性黑素瘤细胞侵袭和失巢凋亡的影响[J]. 中华皮肤科杂志, 2014, 47(6): 413-416. DOI:10.3760/cma.j.issn.0412-4030.2014.06.012 |
 2019, Vol. 55
2019, Vol. 55
