丘脑底核是基底神经节重要的信息整合核团和唯一的兴奋性核团[1], 基底神经节是锥体外系调节躯体运动的中心, 其功能通路的任何部分出现异常,均会导致运动障碍性疾病,如亨廷顿舞蹈病和帕金森病(PD)等[2-4]。越来越多的研究结果表明,丘脑底核在运动控制和行为表现中发挥重要作用,其神经元活动异常与PD的发病密切相关[5-6]。食欲肽(orexins)是由下丘脑中数量有限的orexin能神经元产生[7], 含有130个氨基酸的orexins前体经水解产生orexin-A和orexin-B。Orexin-B主要通过作用于orexin-2(OX2)受体发挥作用[3]。Orexins参与调控睡眠觉醒、运动和学习记忆等多种生物学效应[8]。有研究证实,丘脑底核表达OX2受体并直接接受来自下丘脑orexin能神经元的纤维投射[9]。然而,丘脑底核orexin-B对小鼠运动行为的调控及神经元自发放电的影响目前尚不清楚。因此,本研究应用行为学测试方法以及电生理学技术,探讨丘脑底核orexin-B对正常小鼠运动行为的调控及神经元自发放电的影响。
1 材料与方法 1.1 材料 1.1.1 实验动物健康雄性C57BL/6小鼠,体质量22~25 g,购自江苏常州卡文斯实验动物有限公司。小鼠饲养于室温23~25 ℃、湿度50%~55%、12 h光照12 h黑暗昼夜交替的安静环境中,自由饮水进食,单笼饲养。小鼠实验前饲养2周以适应实验环境。
1.1.2 实验药品Orexin-B购于Tocris公司,用无菌生理盐水稀释为0.1 μmol/L。
1.2 实验方法 1.2.1 实验分组27只正常小鼠随机选择其中5只用于电生理实验,其余22只用于爬杆测试和旷场测试,各11只。实验随机分为两组,对照组(5只)小鼠双侧丘脑底核注射生理盐水0.1 μL,实验组(6只)注射orexin-B溶液0.1 μL。
1.2.2 脑立体定位及套管植入术小鼠用80 g/L水合氯醛麻醉后,固定在脑立体定位仪上,切开头皮,剥离骨膜,使颅骨前后囟位于同一水平面。根据小鼠脑立体定位图谱,将不锈钢套管(长度9.0 mm,内径0.6 mm,外径0.8 mm)植入双侧丘脑底核(前囟后1.8 mm,旁开1.5 mm,深度4.5 mm),并用牙托粉固定。术后连续3 d肌肉注射青霉素(每天8万单位)。待小鼠恢复3 d,进行行为学测试。恢复期间进行接触抚摸以防止出现应激现象。
1.2.3 爬杆实验测试杆长度55 cm,直径1 cm,杆顶固定一个直径为2.5 cm的小木球,杆和木球周围包裹纱布以增加摩擦力防止小鼠打滑摔落。小鼠注射药物后,头朝上置于杆顶部位置,测试并记录小鼠转头时间和小鼠爬杆时间。转头时间是指从小鼠开始运动到头朝下所用的时间;爬杆时间是指小鼠头朝下后开始沿杆自然爬下到前爪触地所用时间。测试前每只小鼠训练2次,正式测试进行5次。
1.2.4 旷场实验旷场行为测试室内光照昏暗,温度、湿度均与饲养环境相同。小鼠注射药物后立即置于方形测试盒内(26.5 cm×26.5 cm×35.5 cm),红外线实时监控15 min,记录单位时间内小鼠运动的总距离。
1.2.5 在体细胞外电生理记录采用单细胞细胞外记录的方法,观察orexin-B对丘脑底核神经元自发放电的影响。小鼠麻醉(200 g/L乌拉坦)后固定在脑定位仪上,切开头皮,剥离骨膜,使颅骨前后囟位于同一水平面。根据小鼠脑立体定位图谱,定位丘脑底核(前囟后1.7~2.3 mm,旁开1.2~1.8 mm,深度4.1~4.8 mm)。实验操作及记录方法参照文献方法[10]。
1.3 统计学分析应用SPSS 22.0软件进行统计学处理,计量资料数据采用x±s表示,多组数据间比较采用单因素方差分析,两组数据比较采用t检验;计数资料比较采用Mann-Whitney U检验。P<0.05为差异有统计学意义。
2 结果 2.1 丘脑底核注射orexin-B对小鼠爬杆行为影响小鼠爬杆实验中,实验组小鼠转头时间及爬杆时间均大于对照组,差异均有显著性(t=2.40、4.59,P<0.05)。见表 1。
| 表 1 两组小鼠爬杆实验及旷场实验结果比较(x±s) |
|
|
小鼠旷场实验中,实验组小鼠在旷场中的运动总距离短于对照组,两组比较差异有显著意义(t=3.14,P<0.01)。见表 1。
2.3 Orexin-B对丘脑底核神经元放电频率的影响电生理实验共记录到11个丘脑底核放电神经元,其平均放电频率为(1.58±0.16)Hz。微压力给予0.1 μmol/L的orexin-B后,可使其中7个神经元放电频率显著增加(加药前为(1.69±0.27) Hz,给予orexin-B后为(3.59±0.26) Hz),差异有统计学意义(t=4.96,P<0.01)。见图 1。其余4个神经元的放电频率没有明显改变(t=0.15,P>0.05)。对orexin-B有兴奋效应的7个丘脑底核神经元,微压力给予生理盐水前后自发放电频率分别为(1.54±0.38)、(1.52±0.36) Hz,差异无显著意义(t=0.25,P>0.05)。微压力给予orexin-B对丘脑底核神经元的兴奋效应平均值为(216.90±118.40)%,与生理盐水对照组细胞平均反应率相比,差异有显著性(Z=-2.72,P<0.01)。
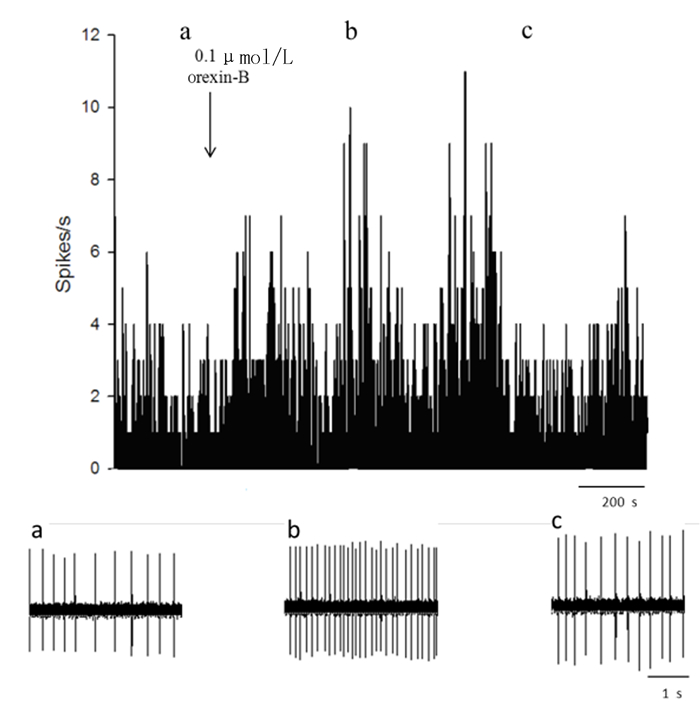 |
| a:小鼠丘脑底核神经元基础放电频率;b:微压力注射orexin-B神经元放电频率;c:反应结束后神经元放电频率。 图 1 Orexin-B对正常小鼠丘脑底核神经元放电频率的影响 |
基底神经节是锥体外系调节躯体运动的中心,锥体外系主要通过大脑皮质-基底神经节-丘脑-大脑皮质环路控制机体的运动行为。丘脑底核作为基底神经节的中继核团,在躯体运动等方面发挥重要作用[11]。在基底神经节间接通路中,丘脑底核与纹状体、苍白球、黑质等核团共同调控机体运动,当其中任一核团出现异常,就会引起多种运动障碍性疾病,如PD等[2, 4, 12]。众所周知,orexin-B是兴奋性神经肽,在基底神经节的间接通路中,orexin-B作用于丘脑底核神经元后,被兴奋的丘脑底核神经元发出兴奋性谷氨酸能纤维至苍白球内侧部和黑质网状带,进而增强发送到丘脑的γ-氨基丁酸能纤维的抑制效应,最终导致丘脑及皮质活动减弱[13]。旷场实验是判断小鼠运动功能和焦虑样情绪的常见方法,其中通过统计单位时间内运动总距离可以反映被测试鼠的水平运动情况和自发活动能力[14-17]。爬杆实验是评价运动障碍性疾病模型小鼠的经典行为学检测方法,广泛应用于PD的研究,通过测定被测试鼠转头时间可以评价其运动协调能力,测定爬杆时间可以评价其运动迟缓等方面[18-20]。本实验行为学结果显示,双侧丘脑底核注射orexin-B的小鼠在旷场实验中自发活动明显减少,在爬杆实验中其运动协调能力也显著下降,提示丘脑底核给予外源性orexin-B可以调控小鼠的运动行为。进一步进行的电生理实验结果显示,orexin-B可提高丘脑底核神经元的兴奋性,在单细胞水平为丘脑底核orexin-B对运动行为的调控提供了电生理学基础。本实验结果为下一步研究丘脑底核orexin-B在PD模型小鼠运动障碍中的作用提供了实验依据。
PD是一种因基底神经节功能异常所致的神经退行性疾病,具有静止性震颤、运动迟缓、动作减少、姿势平衡障碍等多种运动症状[21]。有研究报道,PD晚期病人脑脊液orexin水平降低[22]。然而另有报道,6-羟基多巴胺(6-OHDA)诱导的PD模型大鼠脑脊液中orexin-B水平没有明显改变[23]。本实验结果显示,丘脑底核给予外源性orexin-B能明显抑制正常小鼠的运动行为。那么外源性orexin-B可否通过丘脑底核加重PD模型小鼠的运动障碍,使用OX2受体阻断剂阻断丘脑底核内源性orexin-B后,可否改善PD运动症状以及其受体机制,有待本课题组进一步研究。
综上所述,orexin-B能够兴奋丘脑底核神经元,抑制正常小鼠的运动行为,可能通过丘脑底核参与的基底神经节间接通路调控运动。这为PD相关运动症状的研究与治疗提供了方向与理论依据。
| [1] |
TEPPER J M, ABERCROMBIE E D, BOLAM J P, et al. Basal ganglia macrocircuits[J]. Prog Brain Res, 2007, 160: 3-7. DOI:10.1016/S0079-6123(06)60001-0 |
| [2] |
CAZORLA M, KANG U J, KELLENDONK C. Balancing the basal ganglia circuitry: a possible new role for dopamine D2 receptors in health and disease[J]. Movement Disorders, 2015, 30(7): 895-903. DOI:10.1002/mds.26282 |
| [3] |
SAKURAI T, AMEMIYA A, ISHⅡ M, et al. Orexins and orexin receptors: a family of hypothalamic neuropeptides and G protein-coupled receptors that regulate feeding behavior[J]. Cell, 1998, 92(4): 573-585. DOI:10.1016/S0092-8674(00)80949-6 |
| [4] |
AHN S, ZAUBER S E, WORTH R M, et al. Interaction of synchronized dynamics in cortex and basal ganglia in Parkinson's disease[J]. European Journal of Neuroscience, 2015, 42(5): 2164-2171. DOI:10.1111/ejn.12980 |
| [5] |
DEGOS B, DENIAU J M, CHAVEZ M, et al. Subthalamic nucleus high-frequency stimulation restores altered electrophysiological properties of cortical neurons in parkinsonian rat[J]. PLoS One, 2013, 8(12): e83608. DOI:10.1371/journal.pone.0083608 |
| [6] |
ARISTIETA A, AZKONA G, SAGARDUY A A, et al. The role of the subthalamic nucleus in L-DOPA induced dyskinesia in 6-hydroxydopamine lesioned rats[J]. PLoS One, 2012, 7(8): e42652. DOI:10.1371/journal.pone.0042652 |
| [7] |
DE LECEA L, KILDUFF T S, PEYRON C, et al. The hypocretins: hypothalamus-specific peptides with neuroexcitatory activity[J]. Proceedings of the National Academy of Sciences of the United States of America, 1998, 95(1): 322-327. DOI:10.1073/pnas.95.1.322 |
| [8] |
GAO Heren, ZHUANG Qianxing, ZHANG Yongxiao, et al. Orexin directly enhances the excitability of globus pallidus internus neurons in rat by co-activating OX1 and OX2 receptors[J]. Neuroscience Bulletin, 2017, 33(4): 365-372. DOI:10.1007/s12264-017-0127-0 |
| [9] |
SAKURAI T. The role of orexin in motivated behaviours[J]. Nature Reviews Neuroscience, 2014, 15(11): 719-731. DOI:10.1038/nrn3837 |
| [10] |
王英, 薛雁, 刁汇玲, 等. Orexin-B对正常大鼠苍白球神经元自发放电及运动行为的影响[J]. 青岛大学学报(医学版), 2018, 54(1): 14-16. |
| [11] |
STARR E R, IMBERY J F, COLLINS S A. Subthalamic nucleus cell-specific expression of nicotinic acetylcholine receptors uncovers novel basal ganglia microcircuits[J]. Journal of Neurosci, 2015, 35(30): 10645-10647. DOI:10.1523/JNEUROSCI.1707-15.2015 |
| [12] |
NOVOTNY M, RUSZ J, CMEJLA R, et al. Hypernasality associated with basal ganglia dysfunction: evidence from Parkinson's disease and Huntington's disease[J]. Peer J, 2016, 4: e2530. DOI:10.7717/peerj.2530 |
| [13] |
MORITA M, HIKIDA T. Distinct roles of the direct and indirect pathways in the basal ganglia circuit mechanism[J]. Nihon Shinkei Seishin Yakurigaku Zasshi, 2015, 35(5/6): 107-111. |
| [14] |
LAUREN R, HARMS, DARRYL W, et al. Developmental vitamin D deficiency alters adult behaviour in 129/SvJ and C57BL/6J mice[J]. Behavioural Brain Research, 2008, 187(2): 343-350. DOI:10.1016/j.bbr.2007.09.032 |
| [15] |
孙世光, 王婧婧, 李自发, 等. 旷场实验:昆明小鼠行为学评价方法的重测信度检验[J]. 中华行为医学与脑科学杂志, 2010, 19(12): 1093-1095. |
| [16] |
DR O R, KIM Y, CHOI E J, et al. Antidepressant-like effects of vaccinium bracteatum in chronic restraint stress mice:functional actions and mechanism explorations[J]. The American Journal of Chinese Medicine, 2018, 46(2): 357-387. DOI:10.1142/S0192415X18500180 |
| [17] |
OH D R, KIM Y, JO A, et al. Sedative and hypnotic effects of Vaccinium bracteatum Thunb. through the regulation of serotonegic and GABA(A)-ergic systems: involvement of 5-HT1A receptor agonistic activity[J]. Biomedicine & Pharmacotherapy, 2019, 109: 2218-2227. |
| [18] |
MATSUURA K, KABUTO H, MAKINO H, et al. Pole test is a useful method for evaluating the mouse movement disorder caused by striatal dopamine depletion[J]. Journal of Neuroscience Methods, 1997, 73(1): 45-48. DOI:10.1016/S0165-0270(96)02211-X |
| [19] |
LIU M F, XUE Y, LIU C, et al. Orexin-A exerts neuroprotective effects via OX1R in Parkinson's disease[J]. Frontiers in Neuroscience, 2018, 12. DOI:10.3389/fnins.2018.00835 |
| [20] |
KIM D, KWON S, JEON H, et al. Proteomic change by Korean red Ginseng in the substantia nigra of a Parkinson's disease mouse model[J]. Journal of Ginseng Research, 2018, 42(4): 429-435. DOI:10.1016/j.jgr.2017.04.008 |
| [21] |
KAIA L V, LANG A E. Parkinson's disease[J]. Lancet, 2015, 386(9996): 896-912. DOI:10.1016/S0140-6736(14)61393-3 |
| [22] |
CLUDERAY J E, HARRISON D C, HERVIEU G J. Protein distribution of the orexin-2 receptor in the rat central nervous system[J]. Regulatory Peptides, 2002, 104(1/3, SI): 131-144. |
| [23] |
CUI Longbiao, LI Bowei, JIN Xiaohang, et al. Progressive changes of orexin system in a rat model of 6-hydroxydopamine-induced Parkinson's disease[J]. Neuroscience Bulletin, 2010, 26(5): 381-387. DOI:10.1007/s12264-010-0410-9 |
 2019, Vol. 55
2019, Vol. 55

